Железодефицитные состояния: общая характеристика. Диагностика и лечение.
Коноводова Е.Н., Бурлев В.А., Якунина Н.А., Докуева Р.С–Э.
Железодефицитные состояния (предлатентный, латентный и манифестный дефицит железа) вызываются нарушениями метаболизма железа вследствие его дефицита в организме и характеризуются клиническими и лабораторными признаками, выраженность которых зависит от стадии дефицита железа. Предлатентный, латентный и манифестный дефициты железа у беременных обусловлены повышенным потреблением железа матерью и плодом на фоне его недостаточного экзогенного поступления и/или усвоения и встречаются в любом сроке гестации [1,4,9,14,18].
Предлатентный дефицит железа (ПДЖ) характеризуется отсутствием клинических и биохимических признаков дефицита данного микроэлемента. В физиологических условиях (при беременности, неосложненной дефицитом железа в I триместре) ПДЖ развивается к концу III триместра и характеризуется достоверным снижением (в пределах нормативных значений) показателей всех фондов метаболизма железа. При латентном дефиците железа (ЛДЖ) также отсутствуют клинические признаки дефицита последнего. При этом характерным является снижение запасов железа в депо, однако гематологические показатели поддерживаются в пределах нормативных значений. Отсутствие лечения препаратами железа беременных с ЛДЖ приводит к развитию манифестного дефицита железа (МДЖ) у 65% и увеличению частоты осложненного течения беременности [2,6,10,16]. При МДЖ определяются нарушения во всех фондах метаболизма железа (функциональном, транспортном, запасном и железо– регуляторном), имеются клинические признаки дефицита железа и выше частота акушерских осложнений.
Частота манифестного дефицита железа или железодефицитной анемии (ЖДА) у беременных в мире колеблется от 25 до 50%, в развивающихся странах – от 35 до 75%, а в развитых составляет 18–20% [7,11,15,20, 21]. По данным Министерства здравоохранения и социального развития РФ, в России частота ЖДА у беременных составляет 41,7% [5,6] Частота предлатентного и латентного дефицита железа существенно превышает таковую по манифестному дефициту железа и доходит до 92% [3,7,17].
МДЖ у беременных неблагоприятно отражается на течении беременности, родов, послеродового периода, состоянииплода и новорожденного, способствуя увеличению частоты угрозы прерывания беременности, плацентарной недостаточности, задержки внутриутробного развития и гипоксии плода, преждевременных родов, слабости родовой деятельности, частоты и объема патологической кровопотери в родах и раннем послеродовом периоде, инфекционных осложнений и гипогалактии у родильниц. Кроме того, недостаточное депонирование железа в антенатальном периоде является одной из причин развития дефицита железа и анемии у грудных детей, а также их отставания в психомоторном и умственном развитии в первые годы жизни [2,9,14,17,19].
МДЖ у беременных имеет два клинических варианта. При типичном варианте его течения определяются нарушения во всех фондах метаболизма железа, при атипичном – во всех фондах, кроме запасного. Атипичный вариант МДЖ имеет 2 стадии и развивается, как правило, у беременных с заболеваниями, сопровождающимися воспалением. При первой стадии заболевания определяются нарушения в функциональном и регуляторном фондах, при отсутствии таковых в транспортном. При второй стадии нарушения метаболизма железа более выражены и затрагивают транспортный фонд. Следует отметить, что при МДЖ, кроме лабораторных изменений, имеются клинические признаки дефицита железа, а частота связанных с ним осложнений зависит от клинического варианта его течения. При атипичном МДЖ у беременных достоверно выше отмечается частота преждевременных родов, послеродовых инфекционных осложнений, а также рождение детей с внутриутробной инфекцией по сравнению с беременными с типичным вариантом МДЖ [2].
У беременных и родильниц при развитии железодефицитных состояний отмечается снижение уровня коэффициента адекватности продукции эритропоэтина пропорционально стадии дефицита железа. Частота неадекватной продукции эритропоэтина в среднем выявляется у 47,2% беременных с МДЖ легкой степени, а уродильниц пропорционально степени тяжести МДЖ (у 12% родильниц при легкой степени тяжести, у 50% – при средней и у 80% – при тяжелой степени тяжести МДЖ) [5–7].
Необходимо отметить, что эффективность лечения препаратами железа беременных и родильниц с МДЖ зависит от суточной дозы элементарного железа и от уровня эндогенного эритропоэтина. При адекватном уровне эритропоэтина эффективность лечения в 2,5 раза выше по сравнению с таковой у беременных с неадекватным уровнем [1,5].
Кроме того, применение рекомбинантного эритропоэтина в сочетании с препаратами железа у беременных и родильниц с МДЖ приводит к достоверно большему росту уровня гемоглобина, гематокрита, эритроцитов и объемного транспорта кислорода, а следовательно, к более выраженному клиническому эффекту по сравнению с таковым у женщин, получающих только препараты железа [1,6].
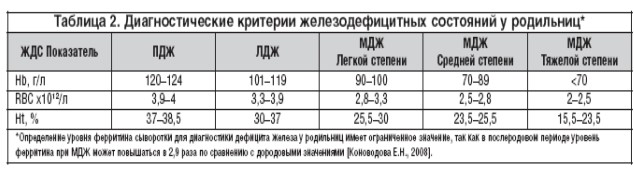
Диагностика ЖДС (табл. 1 и 2) основана на определении у беременных уровней гемоглобина (Hb), эритроцитов (RBC), гематокрита (Ht), сывороточного железа (СЖ), коэффициента насыщения трансферрином (КНТ), сывороточного ферритина (СФ); а у родильниц – Hb, RBC, Ht в связи с тем, что определение уровня ферритина сыворотки длядиагностики ЖДС у родильниц имеет ограниченное значение, так как в послеродовом периоде уровень ферритина может повышаться в 2,9 раза по сравнению с аналогичным показателем до родов.
Особого внимания заслуживает лечение наиболее тяжелой формы ЖДС – манифестного дефицита железа илижелезодефицитной анемии. На первом этапе следует оценить степень тяжести МДЖ (легкая, средняя или тяжелая) с учетом диагностических критериев (табл. 3). При выявлении МДЖ у беременных необходимо также определить его клинический вариант (типичный, атипичный).
В настоящее время у беременных и родильниц при лечении манифестного дефицита железа (МДЖ) применяются следующие варианты назначения препаратов железа:
Пероральный (препараты железа двух– или трехвалентного);
Парентеральный (преимущественно внутривенное введение сахарата железа);
Сочетанное применение препаратов железа с препаратами рекомбинантного эритропоэтина.
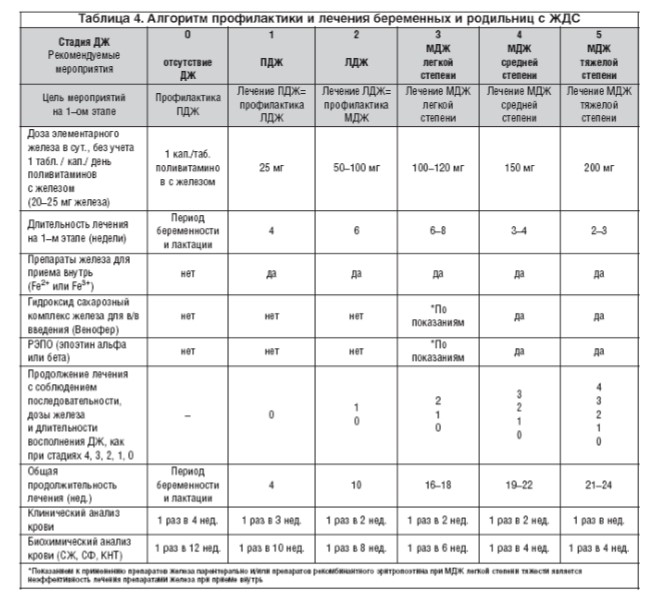
Лечение беременных и родильниц с МДЖ проводится по предложенному нами алгоритму (табл. 4).
«Золотым стандартом» лечения МДЖ у беременных и родильниц является назначение препаратов железа перорально. Начальная доза элементарного железа в сутки и длительность лечения МДЖ зависят от исходной степени тяжести МДЖ (табл. 4). Рекомендуемая терапевтическая доза составляет 100–200 мг элементарного железа в сутки (в зависимости от степени тяжести заболевания). Более высокие дозы не увеличивают эффективность, однако могут учащать побочные эффекты [2,9,12].
Лечение беременных и родильниц с МДЖ должно быть комплексным. Помимо препаратов железа Fe2+ или Fe3+ перорально, показан прием поливитаминов и биологически активных добавок, содержащих железо.
В ряде случаев лечение беременных и родильниц с МДЖ препаратами железа перорально бывает неэффективным [8,13]. Следовательно, при наличии показаний для парентерального применения железа рекомендуется использовать железа (III) гидроксид сахарозный комплекс (Венофер).
Венофер – стимулятор эритропоэза, антианемический препарат. В препарате Венофер железо находится в виде комплексного соединения гидроксида железа (III) (0,02 г железа в 1 мл) с сахарозой. Трехвалентное железо стимулирует образование гема, что способствует в конечном итоге повышению уровня гемоглобина. Поскольку железо в Венофере находится в неионизированной форме, препарат не оказывает таких побочных эффектов, как раздражение слизистой оболочки ЖКТ, окрашивание зубов, металлический привкус во рту. После однократного внутривенного введения препарата Венофер, содержащего 100 мг железа, максимальная концентрация железа достигается спустя 10 мин после инъекции. Период полувыведения препарата около 6 ч. Благодаря низкой стабильности железа сахарата в сравнении с трансферрином, наблюдается конкурентный обмен железа в пользу трансферрина.
Многоядерные центры железа (III) гидроксида окружены снаружи множеством нековалентно связанных молекул сахарозы. В результате образуется комплекс, молекулярная масса которого составляет приблизительно 43 кД, вследствие чего его выведение через почки в неизмененном виде невозможно. Данный комплекс стабилен и в физиологических условиях не выделяет ионы железа. Железо в этом комплексе связано со структурами, сходными с естественным ферритином.
Препарат назначают по 0,05–0,2 г на 400 мл 0,9% раствора хлорида натрия в сутки внутривенно капельно. Стандартная дозировка: 5–10 мл Венофер (100–200 мг железа) 1–3 раза в неделю в зависимости от уровня гемоглобина.
Следует отметить, что Венофер предпочтительнее вводить в ходе капельной инфузии для того, чтобы уменьшить риск выраженного снижения артериального давления и опасность попадания раствора в околовенозное пространство. Непосредственно перед инфузией Венофер нужно развести 0,9% раствором натрия хлорида в соотношении 1:20 [например, 1 мл (20 мг железа) в 20 мл 0,9% раствора натрия хлорида]. Полученный раствор вводится со следующей скоростью: 100 мг железа – не менее чем за 15 минут; 200 мг железа — в течение 30 минут; 300 мг железа – в течение 1,5 часов; 400 мг железа – в течение 2,5 часов; 500 мг железа – в течение 3,5 часов. Введение максимально переносимой разовой дозы, составляющей 7 мг железа/кг массы тела, следует производить в течение минимум 3,5 часов, независимо от общей дозы препарата.
Перед первым капельным введением терапевтической дозы препарата Венофер необходимо ввести тест–дозу – 20 мг железа. При отсутствии нежелательных явлений оставшуюся часть раствора следует вводить с рекомендованной скоростью.
Расчет дозы: доза рассчитывается индивидуально в соответствии с общим дефицитом железа в организме по формуле:
Общий дефицит железа (мг) = масса тела (кг) х (нормальный уровень Hb – Hb больного) (г/л) х 0,24* + депонированное железо (мг).
Общий объем препарата Венофер, который необходимо ввести (в мл) = Общий дефицит железа (мг) / 20 мг/мл.
Оценка эффективности лечения проводится через 2–3 недели от начала лечения препаратами железа путем подсчета процентного роста значений гематологических показателей (Hb, Ht, RBC) по отношению к исходному уровню. Повышение Hb менее чем на 6% (2% в неделю); Ht – менее чем на 1,5% (0,5% в неделю); RBC – менее чем на 3% (1% за неделю) свидетельствуют о неэффективности лечения.
При отсутствии эффекта от лечения МДЖ легкой степени тяжести препаратами железа, а также при лечении беременных и родильниц с МДЖ тяжелой и средней степени показано применение эпоэтина–альфа или –бета (по 50–60 ед/кг массы тела – у беременных после 20 недель гестации, 2–3 раза в неделю, подкожно, 6 инъекций и по 70–80 ед/кг массы тела – у родильниц, через день, подкожно, 3–6 инъекций) в сочетании с препаратами сульфата железа: железа сульфат/фолиевой кислотой/цианокобаламином, железа сульфат/аскорбиновой кислотой, железа сульфат/фолиевой кислотой, перорально (200 мг элементарного железа в сутки) или с железа (III) гидроксид сахарозным комплексом (Венофер) по 5–10 мл в 200–400 мл физиологического раствора внутривенного капельно через день.
Лечение беременных с атипичным клиническим вариантом МДЖ, развившимся на фоне заболеваний, сопровождающихся воспалением (заболевания почек; острые и хронические инфекционно–воспалительные заболевания; аутоиммунные заболевания; злокачественные новообра зования и др.) рекомендуется начинать в первую очередь с терапии основного заболевания, вызвавшего воспалительный процесс в организме. При этом в случае отсутствия эффекта от лечения препаратами железа в течение 2–3 недель необходимо использовать препараты эритропоэтина в сочетании с препаратами сульфата железа перорально или с железа (III) гидроксид сахарозным комплексом (Венофер) парентерально.
Родильницам с МДЖ после кесарева сечения в первые трое суток после операции, учитывая диету, рекомендуется прием препаратов железа внутрь в форме раствора: железа протеинит сукцинилат внутрь 1 флакон 2 раза в сутки, раствор полимальтозного комплекса гидроксида железа (Мальтофер) 100 мг 2 раза в сутки в виде сиропа или железа глюконат внутрь 1 амп. 2 раза в сутки или железа (III) гидроксид сахарозный комплекс (Венофер) парентерально.
Восполнение дефицита железа при МДЖ следует проводить поэтапно. Доза элементарного железа в сутки и продолжительность приема его препаратов зависят от этапа терапии. При лечении МДЖ тяжелой степени необходимо проведение 5 этапов восполнения ДЖ; при МДЖ средней степени тяжести – 4 этапа; при МДЖ легкой степени тяжести – 3 этапа; при ЛДЖ – 2 этапа; при ПДЖ — 1 этап. Обоснованием перехода к следующему этапу лечения служат значения гематологических (Hb, RBC, Ht) и феррокинетических показателей (СЖ, КНТ, СФ), соответствующих определенным стадиям жефицита железа. Гематологические и феррокинетические показатели рекомендуется определять в начале и в конце каждого этапа лечения (табл. 4).
Таким образом, применение алгоритма диагностики и лечения МДЖ у беременных и родильниц, учитывающего клинический вариант (типичный, атипичный), стадию, степень тяжести, уровень коэффициента адекватности продукции эритропоэтина (адекватный, неадекватный) обеспечивает эффективное патогенетическое лечение МДЖ благодаря индивидуально подобранной терапии (препараты железа, доза, форма, способ введения и длительность приема, сочетание с поливитаминами и препаратами эритропоэтина). Все это приводит к сокращению сроков лечения, снижению частоты гемотрансфузий, улучшению качества жизни и уменьшению продолжительности пребывания в стационаре.


Литература
Бурлев В.А., Коноводова Е.Н. Синдром неадекватной продукции эритропоэтина у беременых с гестозом. // Вопросы гинекологии, акушерства и перинатологии.–2007.–Т.6, № 6.– С.16–21.
Коноводова Е.Н. Железодефицитные состояния у беременных и родильниц (патогенез, диагностика, профилактика, лечение). Автореф. дисс. доктора мед. наук.– М.–2008.– 46с.
Серов В.Н., Бурлев В.А., Коноводова Е.Н. и др. Железодефицитные состояния у беременных.// Российский клинический опыт для акушеров– гинекологов: серия научно–практических информационных материалов.– М., 2005.– 32 с.
Серов, В.Н. Бурлев В.А., Коноводова Е.Н. Железодефицитные состояния у беременных и родильниц. // Глава №5 в книге:Алгоритмы диагностики и лечения гинекологических заболеваний. Под редакцией В.Н. Серова, «Литтерра».– М., 2008.– 160с.
Серов В.Н., Бурлев В.А., Коноводова Е.Н. и др. Профилактика манифестного дефицита железа у беременных и родильниц (медицинская технология). // Разрешение (серия АА №0000150) федеральной службы по надзору в сфере здравоохранения и социального развития на применение новой медицинской технологии ФС №2010/004 от 18.01.2010 г., М.: МедЭкспертПресс, 2010.– 16с.
Серов В.Н., Бурлев В.А., Коноводова Е.Н. и др. Лечение манифестного дефицита железа у беременных и родильниц (медицинская технология). // Разрешение (серия АА №0000151) федеральной службы по надзору в сфере здравоохранения и социального развития на применение новой медицинской технологии ФС №2010/003 от 18.01.2010 г. М.: МедЭкспертПресс, 2010.– 28с.
Хух Р,. Брейман К. Анемия во время беременности и в послеродовом периоде.– М.: «Триада–Х», 2007.– 73с.
Шалина Р.И., Кутакова Ю.Ю., Бреусенко Л.И. и др. Оценка эффективности применения препарата Венофер при железодефицитных состояниях после акушерских кровотечений. // Вопросы гинекологии, акушерства и перинатологии.–2004.–Т.3,№ 1.– C.37–42.
Allen L.H. Anemia and iron deficiency: effects on pregnancy outcome. // Am. J. Clin. Nutr.– 2000.–Vol. 71.– P.1280–1284.
Bhandal N., Russel R. Intravenosus versus oral iron therapy for postpartum anaemia. // BJOG.– 2006.– Vol.113, № 11.– Р.1248–1252.
Breymann C, Honegger C, Holzgreve W, Surbek D. Диагностика и лечение железодефицитной анемии во время беременности и в послеродовом периоде. Arch Gynecol Obstet. 2010 Nov;282(5):577–80.
Dijkstra F, Jozwiak M, De Matteo R. et al. Erythropoietin ameliorates damage to the placenta and fetal liver induced by exposure to lipopolysaccharide. Placenta. 2010;31(4):282–8.
Ervasti M, Kotisaari S, Heinonen S, Punnonen K. Elevated serum erythropoietin concentration is associated with coordinated changes in red blood cell and reticulocyte indices of pregnant women at term. Scand J Clin Lab Invest. 2008;68(2):160–5. Epub 2007 Nov 21.
Gordon N. Iron deficiency and the intellect. Brain & Development. 2003;25:3–8.
Khalafallah A. et al. Контролируемое проспективное рандомизированное исследование внутривенного применения препаратов железа по сравнению с пероральным приемом для умеренной железодефицитной анемии при беременности. J Intern Med. 2010 Sep;268(3):286–95.
Krafft A, Bencaiova G, Breymann C. Selective use of recombinant human erythropoietin in pregnant patients with severe anemia or nonresponsive to iron sucrose alone. Fetal Diagn Ther. 2009;25(2):239–Epub 2009 Jun 5.
Lozoff B. Iron deficiency and child development. Food Nutr Bull. 2007;28:560–571.
Milman N. Prepartum anaemia: prevention and treatment. Ann Hematol. 2008;87:949–959.
Toth B, Fischl A, Scholz C, Kunze S, Friese K, Jeschke U. Erythropoietin and erythropoietin receptor expression in normal and disturbed pregnancy. Eur J Obstet Gynecol Reprod Biol. 2008;140(2):192–200.
Wagstrom, E., Akesson A., Van Rooijen M. et al. Erythropoietin and intravenous iron therapy in postpartum anaemia. Acta Obstet Gynecol Scand. 2007;86(8):957–62.
Wulff, M., Ekstrom E.–C. Iron supplementation during pregnancy in Sweden: to what extend is the national recommendation followed? Acta Obstet. Gynecol. Scand. 2003;82:628–35.










Комментировать