Пневмония: общая характеристика. Классификации, диагностика, симптоматика.
Н. Н. Козачок, М. Н. Селюк, С. А. Бычкова, Украинская военномедицинская академия, Киев
История изучения пневмонии насчитывает не одно тысячелетие. Один из первых ее исследователей Гиппократ, работы которого дошли до наших дней, описал основные симптомы пневмонии и ее лечение. Античные лекари отмечали, что пневмония это комплексное и многостадийное заболевание, требующее особого внимания врачей [1, 15].
Несмотря на столь долгую историю изучения проблемы, вопросы лечения пневмонии попрежнему актуальны. Пневмонию и сегодня относят к наиболее широко распространенным заболеваниям. Согласно данным ВОЗ, в 40% случаев продолжительность жизни людей в мире сокращается вследствие инфекционных болезней, а пневмония занимает четвертое место среди причин смерти в общей популяции [911]. Невзирая на успехи медицины (новые методы и подходы к диагностике, лечению и профилактике пневмоний), распространенность этого заболевания увеличивается с каждым годом, что, в свою очередь, ведет к большим экономическим потерям за счет высоких показателей инвалиди зации и смертности. Сегодня пневмония рассматривается как острое инфекционное заболевание преимущественно бактериальной этиологии, характеризующееся очаговым поражением респираторных отделов легких и наличием внутриальвеолярной экссудации. Термин «хроническая пневмония» в современных рекомендациях не применяется [9].
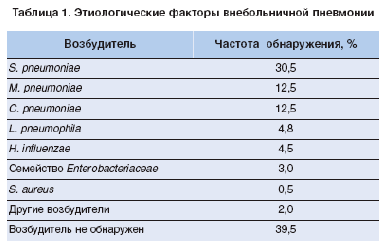
В Международной классификации болезней, травм и причин смерти Х пересмотра (1992) из рубрики «Пневмония» исключены заболевания, спровоцированные физическими факторами и факторами аллергического или сосудистого происхождения, а в основу классификации положена этиология. Безусловно, классификация пневмонии, основанная на типе ее возбудителя, является оптимальной, поскольку позволяет обосновать этио тропную терапию. На сегодняшний день выделены патогены, чаще всего вызывающие внебольничную пневмонию (ВП) (табл. 1).
К сожалению, невозможность идентификации патогена в сжатые сроки крайне затрудняет практическое применение данной классификации, поскольку адекватная терапия пневмонии требует введения первой дозы антибактериального препарата (АБП) не позднее 8 ч от начала развития заболевания, а использование стандартных методов лабораторной диагностики позволяет идентифицировать патоген лишь через 4872 ч после изъятия образца [11]. Это и побудило клиницистов разработать классификацию, в которой учтены условия развития заболевания, особенности инфицирования легочной ткани и состояние иммунологической реактивности организма. Такой подход позволяет с высокой степенью вероятности определять этиологию заболевания и назначать адекватное лечение. Современная классификация пневмонии по особенностям инфицирования и условиям возникновения выглядит следующим образом [13, 16]:
- негоспитальная, или внебольничная пневмония:
- типичная;
- атипичная;
- внутригоспитальная, госпитальная, или нозокомиальная пневмония (НП) (развившаяся в течение 48 ч после госпитализации пациента):
- у лиц с самостоятельным дыханием;
- у лиц с искусственным дыханием;
- аспирационная:
- аспирация орофарингеальной микрофлоры;
- аспирация желудочнокишечной микрофлоры;
- пневмония при иммунодефицитных состояниях:
- врожденном иммунодефиците;
- ВИЧинфекции;
- иммуносупрессии.
Практическая значимость этой классификации, в основу которой положены этиология и степень тяжести заболевания, в первую очередь влияющие на выбор антибиотика, бесспорна.
Создание новых протоколов ведения пациентов с пневмонией связано с тем, что в последние годы были получены новые данные о резистентности ключевых бактериальных возбудителей заболеваний верхних дыхательных путей, пополнился арсенал АБП, проанализированы неудачи проводимой терапии. Помимо этого, значительно расширилась доказательная база, которую следует учитывать при ведении данной категории пациентов, опубликованы результаты новых контролируемых клинических исследований, метаанализов и систематических обзоров. Все эти обстоятельства предопределили создание новых рекомендации, подготовленных экспертами Европейского респираторного общества (European Respiratory Society ERS) и Европейского общества по клинической микробиологии и инфекционным болезням (European Society of Clinical Microbiology and Infectious Diseases ESCMID) [14, 16]. В нашей стране к таким рекомендациям относится приказ МЗ Украины № 128 от 19.03.2007 г. «Об утверждении клинических протоколов оказания медицинской помощи по специальности «Пульмонология» [9].
Внебольничная пневмония одно из самых распространенных заболеваний, с которым каждодневно приходится иметь дело практическому врачу. Для правильного выбора лечения больных ВП подразделяют на 4 категории. В зависимости от категории, к которой принадлежит пациент, назначают амбулаторное либо стационарное лечение. Для каждой группы больных характерен свой спектр возбудителей, и знание наиболее распространенной этиологии упрощает выбор антибактериального препарата.
Диагноз пневмонии верифицируется на основании комплексного подхода, предполагающего анализ клинических симптомов, рентгенологических и лабораторных данных, результатов микробиологического исследования, а также эффективности проводимой антибактериальной терапии.
Клиническая диагностика основывается на ряде симптомокомплексов:
- кашель + гнойная мокрота + крепитация;
- кашель + гнойная мокрота + клинические признаки пневмонии;
- признаки консолидации легочной ткани (три и более: укорочение перкуторного звука, бронхиальное дыхание, звучная крепитация, усиление голосового дрожания и бронхофонии).
Чувствительность и специфичность клинических признаков в диагностике ВП составляют 74 и 84% соответственно. Ни один из симптомов пневмонии не является специфичным, но отсутствие одного или более из них делает диагноз заболевания менее вероятным.
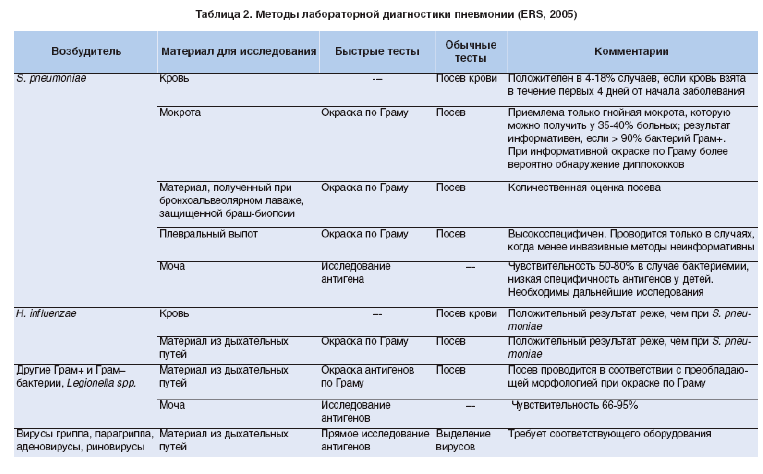
Методы лабораторной диагностики пневмонии, предложенные ERS (2005), представлены в таблице 2 [16].
Среди лабораторных методов в Украине наиболее широко применяются рутинные и специальные тесты. К первым относятся:
- бактериоскопия окрашенной по Граму мокроты;
- посев мокроты (стационарные больные);
- защищенная брашбиопсия (катетерщетка);
- при НП у интубированных пациентов эндотрахеаль ная аспирация.
К специальным тестам относят:
- определение в моче антигена Legionella pneumophila серогруппы 1; исследование проводится у всех больных с тяжелой ВП, а также при наличии соответствующих клинических/эпидемиологических данных в пользу легионеллезной пневмонии (ERS, 2005);
- определение антигена возбудителя с использованием моноклональных антител, ДНКзондирования или полимеразной цепной реакции;
- определение ВИЧинфекции у всех пациентов в возрасте от 15 до 54 лет;
- для НП исследование гемокультуры (2 образца из двух вен) [11].
Одним из методов подтверждения диагноза является рентгенодиагностика. Однако высокая частота ложноотрицательных результатов при данной патологии не позволяет абсолютно точно верифицировать диагноз. Отсутствие изменений на рентгенограмме может быть обусловлено обезвоживанием организма, ранними стадиями заболевания (стетоакустические данные могут опережать рентгенологическую симптоматику приблизительно на 24 ч), выраженной нейтропе нией. Чувствительность рентгенографии в диагностике очаговоинфильтративных изменений в легких составляет 5687%.
При проведении рентгенодиагностики пневмонии также необходимо помнить о возможности ложноположительных результатов. Следует исключить очаговые поражения легких, такие как лучевой пневмонит, «бензиновая пневмония», а также аллергические заболевания (легочную эозинофилию) и очаговые поражения легких сосудистого происхождения (инфаркт легкого на почве тромбоэмболии легочной артерии, гранулема тоза Вегенера) (Рекомендации Канадского общества инфекционных болезней/Канадского торакального общества [CIDS/CTS], 2000).
Оценку течения заболевания проводят по так называемым малым и большим критериям тяжести (приказ МЗ Украины № 128 от 19.03.2007 г.).
К «малым» критериям тяжелого течения ВП относят:
- частоту дыхания 30 и более в минуту;
- нарушение сознания;
- SaO2 менее 90%, PaO2 менее 60 мм рт. ст;
- систолическое артериальное давление ниже 90 мм рт. ст.;
- двустороннее или мультилобарное поражение, плевральный выпот, полостные распады.
«Большие критерии» тяжелого течения ВП включают:
- необходимость проведения искусственной вентиляции легких;
- быстрое прогрессирование пневмонического инфильтрата более чем на 50% в сравнении с исходными данными в течение ближайших 48 ч;
- септический шок или необходимость введения вазо прессоров;
- наличие острой почечной недостаточности (количество мочи 80 мл за 4 ч, уровень креатинина более 0,18 ммоль/л при отсутствии хронической почечной недостаточности).
О тяжелом течении пневмонии говорят при наличии одного «большого» или двух «малых» критериев [912].
Критерии риска летального исхода или осложненного течения изложены в шкале PORT (1997) и базируются на учете возраста больного, степени воспалительного процесса, признаков интоксикации, наличия сопутствующей патологии.
В 2003 г. была опубликована шкала CRB для определения вариантов лечения больных ВП в зависимости от степени тяжести заболевания (W.S. Lim et al., 2003), предполагающая наличие следующих признаков:
- нарушение сознания;
- частота дыхания >30 в минуту;
- артериальное давление систолическое <90 мм рт. ст., диастолическое <60 мм рт. ст.;
- возраст >65 лет.
При отсутствии признаков тяжести ВП назначают амбулаторное лечение, при наличии 12 признаков лечение в стационаре, 34 признаков неотложную госпитализацию в отделение реанимации и интенсивной терапии.
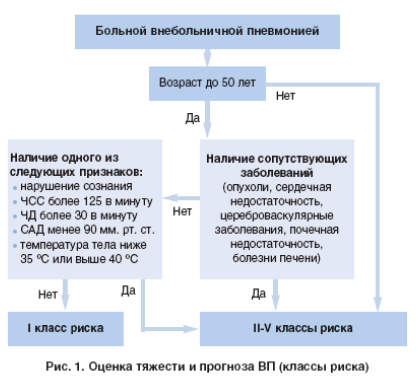
На рисунке 1 отображен алгоритм оценки степени риска больных ВП, предлагаемый российскими пульмонологами.
После верификации диагноза решается вопрос о назначении соответствующей терапии. Лечение проводится дифференцированно, с учетом вышеперечисленных критериев. Алгоритм дифференцированной терапии представлен на рисунке 2.
Согласно недавно изданному приказу МЗ Украины № 128 от 19.03.2007 г., больные ВП подразделяются на категории, аналогичные указанным в предыдущих рекомендациях. Что касается вопросов рекомендованной терапии, то в этот раздел внесены коррективы, основанные на новых данных, полученных при изучении резистентности основных возбудителей к АБП. Пациенты с нетяжелым течением заболевания, без сопутствующей патологии и «модифицирующих» факторов риска появления отдельных возбудителей не нуждаются в госпитализации и лечатся амбулаторно. Также к амбулаторным больным отнесены пациенты II группы (с нетяжелым течением, которые не нуждаются в госпитализации, с наличием сопутствующей патологии и/или других «модифицирующих» факторов). Препаратами выбора у таких больных являются АБП, проявившие максимальную эффективность в отношении основных возбудителей ВП, наилучшую переносимость и максимальное удобство применения. В лечении амбулаторных форм ВП предпочтение следует отдавать пероральным АБП. Таким образом, сегодня антибактериальную терапию амбулаторным больным 1 группы необходимо проводить перо ральными АБП на протяжении 710 дней.
Антибактериальная терапия пневмоний является наиболее рациональным видом лечения, поскольку носит этиотропный характер. Успех лечения пневмонии в значительной степени зависит от безошибочной идентификации возбудителя. Даже при современном оснащении бактериологической службы медицинского учреждения начальное антибактериальное лечение назначается эмпирически с учетом анамнеза, клинической картины, эпидемиологической ситуации. В большинстве современных руководств к выбору АБП рекомендуется подходить с учетом деления пневмоний на внебольничные и госпитальные, микрофлора которых принципиально отличается и, следовательно, требует назначения различных антибиотиков. При ВП актуальны пенициллины (особенно в сочетании с ингибиторами рлактамаз) и макролиды. При НП предпочтение отдается противостафилококковым антибиотикам и АБП, действующим на грамотрицательную флору и анаэробы (гликопептидам, цефалоспоринам II и III поколения, фторхинолонам). Дополнительным критерием выбора антибиотика является возраст младше или старше 60 лет. Следует отметить, что хотя этот критерий апробирован в масштабных статистических исследованиях, его адекватное применение не гарантирует успеха в каждом конкретном клиническом случае. Другим чрезвычайно важным критерием выбора антибактериальной терапии является тяжесть заболевания.
К основным принципам антибактериальной терапии ВП относят своевременное начало лечения, охват наиболее вероятных возбудителей заболевания (S. pneumoniae, «атипичных» микроорганизмов), учет местных эпидемиологических особенностей и данных по микробной резистентности. В нашей стране на сегодняшний день отсутствуют доказательные данные по резистентности микроорганизмов к АБП. Несмотря на появление в последние годы совместных с российскими учеными проектов по изучению антибиотикорезистентно сти [5, 6], выбор АБП в Украине все еще производится с учетом данных по резистентности, накопленных в других странах (России, Чехии, Словакии, Польше). Наиболее изученными причинами резистентности являются: продукция бактериями разрушающих антибиотик ферментов, изменение структуры клеточных мишеней, перестройка каналов в клеточной стенке бактерий и уменьшение ее проницаемости для антибиотика, эффлюкс АБП из клетки и формирование метаболического «шунта» [2]. С каждым годом фармакотерапия ВП существенно корректируется, что обусловлено рядом факторов:
- развитием и распространением устойчивости среди наиболее актуальных респираторных патогенов;
- внедрением в медицинскую практику инновационных микробиологических методов диагностики, новых антибиотиков или их лекарственных форм;
- новыми подходами к оценке прогноза и степени тяжести ВП.
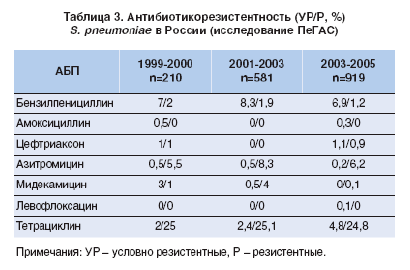
Все вышеизложенное заставляет медиков периодически обновлять свои рекомендации с учетом результатов новейших исследований ключевого фактора, определяющего характер терапии, резистентности к антибиотикам. Постоянное изучение вопроса резистентности основных возбудителей к АБП значительно упрощает работу клиницистов. Результаты недавно проведенного масштабного российского 6летнего исследования ПеГАС позволяют и нашим врачам грамотно подбирать антибактериальную терапию больным ВП. Данные по резистентности S. pneumoniae [5, 6] (одного из наиболее распространенных возбудителей ВП) в России представлены в таблице 3.
Streptococcus pneumoniae один из ведущих возбудителей ВП среди пациентов как с легким, так и с тяжелым ее течением (около 20%). У больных пневмонией с бактериемией S. pneumoniae является причиной более 66% всех случаев ВП.
Второе место по значению среди возбудителей ВП занимают атипичные микроорганизмы Mycoplasma pneumoniae и Chlamydophila pneumoniae (до 1020%), распространенность которых варьирует в зависимости от времени года, возраста больных, географического региона.
Роль Staphylococcus aureus, Legionella pneumophila и грамотрицательных бактерий (Klebsiella pneumoniae, Pseudomonas aeuruginosa и др.) в генезе ВП не столь значительна, но возрастает по мере увеличения тяжести заболевания. Инфекции Legionella spp. встречаются в основном в регионах с теплым климатом (страны Средиземноморья) и довольно редко в странах Северной Европы [7].
Значительно увеличился удельный вес пневмоний, вызываемых штаммами S. pneumoniae, устойчивыми к пенициллину и другим антибиотикам (полирезистент ные штаммы). Доля штаммов S. pneumoniae, резистентных к пенициллину, в мире варьирует от 5 до 50% в зависимости от географического региона, популяции (преобладает среди детей), локализации инфекции (преимущественно в назофарингеальной зоне) и клинического окружения (чаще в стационаре). По данным Российского многоцентрового исследования ПеГАС1, на долю пенициллиноустойчивых приходится 9% всех выделенных штаммов S. pneumoniae (умеренно резистентных 7%, высокорезистентных 2%) [6].
Основываясь на данных по резистентности
- S. pneumoniae, отечественные ученые рекомендуют осуществлять выбор АБП по схеме, показанной в таблице 4 (приказ МЗ Украины № 128).
Основными целями антибактериальной терапии являются:
- эрадикация патогена;
- купирование клинической симптоматики. Рациональная антибиотикотерапия базируется на следующих принципах:
- учете локальных и региональных данных относительно резистентности возбудителей;
- адекватности дозирования АБП;
- расчете разовой дозы АБП;
- кратности применения антибиотика;
- учете фармакокинетических/фармакодинамических параметров и риска побочных действий препарата;
- предварительной оценке стартовой антибиотикотера пии через 4872 ч от начала лечения.
- обладать свойством быстрого и адекватного проникновения в ткани, слизистую оболочку, бронхи, паренхиму и жидкости респираторного тракта; в случае внутриклеточных возбудителей накапливаться в высокой концентрации интрацеллюлярно;
- обладать способностью концентрироваться в локусе инфекции;
- накапливаться в респираторном тракте в концентрациях, превышающих таковые в сыворотке крови;
- обладать длительным периодом полувыведения (T1/2) из организма, что позволяет уменьшить кратность приема;
- обладать длительным T1/2 из тканей и жидкостей респираторного тракта, существенно превышающим таковой в сыворотке крови;
- иметь широкий спектр терапевтических концентраций.
Несмотря на широкий арсенал АБП, только незначительное их количество может быть использовано в терапии BП [6].
Основной проблемой лечения пневмококковых инфекций является устойчивость S. pneumoniae к АБП. Наиболее востребованы в терапии BП препараты группы пенициллинов, что обусловлено, прежде всего, высокой чувствительностью основных возбудителей к данному классу лекарственных средств (ЛС). B большинстве стран и сегодня устойчивость пневмококков к пенициллину остается невысокой, хотя количество резистентных штаммов также увеличилось. Среди стран СНГ достаточно полно изучена резистентность S. pneumoniae к АБП в России. Одним из немногих АБП, сохраняющих максимально высокую антимикробную активность в отношении S. pneumoniae, является амок сициллин [57].
К факторам риска пенициллинорезистентности S. pneumoniae относят:
- возраст больных младше 7 и старше 60 лет;
- наличие тяжелых соматических заболеваний;
- частое и длительное лечение антибиотиками в анамнезе;
- проживание в домах престарелых.
Поскольку механизмы резистентности к пенициллину у пневмококка и гемофильной палочки различны (изменения мембраны и выработка рлактамаз соответственно), то защищенные пенициллины (амокси циллин/клавуланат, ампициллин/сульбактам) активны против H. influenzae, продуцирующей рлактамазу.
Bедущим защищенным антибиотиком пенициллинового ряда является Амоксиклав (амоксициллин, защищенный от действия рлактамаз клавулановой кислотой), обладающий высокой бактерицидной активностью, в том числе к штаммам микроорганизмов, резистентных к амоксициллину.
- аэробных грамположительных бактерий (включая штаммы, продуцирующие рлактамазы): Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pyogenes, Streptococcus anthracis, Streptococcus pneumoniae, Streptococcus viridans, Enterococcus faecalis, Corynebacterium spp., Listeria monocytogenes;
- анаэробных грамположительных бактерий: Clostridium spp., Peptococcus spp., Peptostreptococcus spp.;
- аэробных грамотрицательных бактерий (включая штаммы, продуцирующие рлактамазы): Escherichia coli, Proteus mirabilis, Proteus vulgaris, Klebsiella spp., Salmonella spp., Shigella spp., Bordetella pertussis, Yersinia enterocolitica, Gardnerella vaginalis, Neisseria meningitidis, Neisseria gonorrhoeae, Moraxella catarrhalis, Haemophilus influenzae, Haemophilus ducreyi, Yersinia (ранее Pasteurella) multocida, Campylobacter jejuni;
- анаэробных грамотрицательных бактерий (включая штаммы, продуцирующие рлактамазы): Bacteroides spp., в том числе Bacteroides fragilis.
Клавулановая кислота ингибирует II, III, IV и V типы Рлактамаз, неактивна в отношении рлактамаз I типа, продуцируемых Enterobacter spp., Pseudomonas aeruginosa, Serratia spp., Acinetobacter spp. Она обладает высокой тропностью к пенициллиназам, благодаря чему образует стабильный комплекс с ферментом, препятствующий ферментативной деградации амоксицил лина под влиянием рлактамаз.
Широкий спектр антимикробного действия и активность в отношении амоксициллинрезистентных штаммов делают Амоксиклав незаменимым в лечении бронхолегочной инфекции, особенно при высоком риске наличия возбудителей, продуцирующих рлактамазы, преимущественно у больных с иммунодефицитом и при внутрибольничной инфекции. Фармакологические характеристики амоксициллина и клавулановой кислоты очень похожи. При внутривенном введении их концентрации в сыворотке крови многократно превосходят необходимые. При пероральном приеме они быстро абсорбируются. Пиковые уровни обоих соединений в сыворотке крови достигаются примерно через час после приема препарата. Одновременное употребление пищи не влияет на абсорбцию. Препарат хорошо распределяется в органах и тканях, создавая концентрацию, вполне достаточную для уничтожения штаммов чувствительных бактерий [2, 3].
Амоксиклав легко проникает в различные ткани и жидкости. Помимо плазмы крови, его высокая концентрация наблюдается в мокроте, бронхиальном секрете, тканях легкого, плевральной жидкости, достигая в большинстве случаев адекватных антибактериальных уровней. Период полувыведения для обоих компонентов составляет в среднем около 1 ч. Основная часть препарата выводится через почки.
Амоксиклав превосходит другие пенициллиновые антибиотики в отношении фармакокинетических свойств, в частности благодаря большей биодоступности при пероральном приеме, возможности одновременного приема с пищей или молоком, меньшей степени связывания с белками плазмы и др. Эффективность монотерапии (один антибиотик, один курс) в группе пациентов, получающих Амоксиклав, достоверно выше. Необходимо отметить также более низкую антибактериальную нагрузку в группе Амоксиклава, где курс лечения требует в среднем меньших доз [8].
Оба компонента препарата метаболизируются в печени: амоксициллин на 10% от введенной дозы, клаву лановая кислота на 50%.
Препарат выводится в основном почками (клубочковая фильтрация и канальцевая секреция): 5078% дозы амоксициллина и 2540% клавулановой кислоты экскретируются в неизмененном виде в течение первых 6 ч после приема.
Побочные эффекты при применении препарата носят легкий, преходящий характер; отмечаются расстройства со стороны желудочнокишечного тракта и аллергические реакции. Амоксиклав разрешен к применению во всех триместрах беременности [2].
Имеется несколько лекарственных форм препарата: таблетки по 375 мг, 625 мг и 1000 мг, предназначенные для перорального применения, что позволяет использовать их в амбулаторной практике, и флаконы по 600 мг и 1200 мг для парентерального введения.
Амоксиклав можно сочетать с АБП других групп. Доступность различных лекарственных форм данного антибиотика подразумевает возможность как парентеральной терапии, так и приема per os. При лечении нетяжелых (амбулаторных) форм ВП и обострений хронического бронхита предпочтение следует отдавать перо ральным формам антибиотика. При тяжелом течении инфекции АБП необходимо вводить парентерально. Высокоэффективной является и ступенчатая терапия, которая предполагает переход с парентерального пути введения препарата на пероральный при условии стабилизации состояния больного или улучшения течения заболевания (обычно на 23й день от начала лечения).
Ступенчатая антибактериальная терапия эффективна при пневмониях и обострениях хронических бронхитов. Средняя продолжительность парентерального применения антибиотиков составляет 23 дня, а последующая пе роральная терапия длится, как правило, 57 дней.
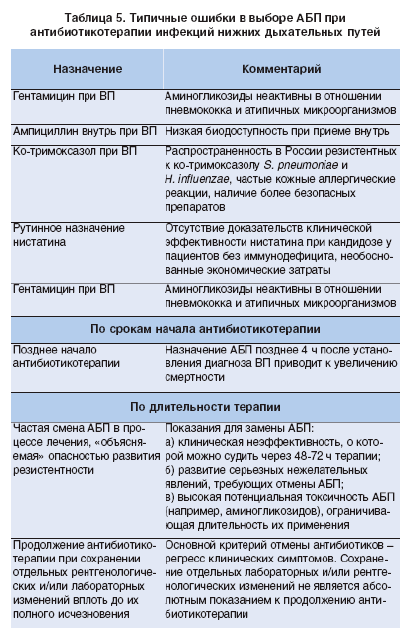
Почему же всетаки эффективность лечения не всегда оправдывает ожидания? Прежде всего, в результате ошибок, свойственных как отечественным, так и российским клиницистам. Наиболее распространенные ошибки при назначении антибактериальной терапии приведены в таблице 5.
В России были проанализированы результаты лечения 778 амбулаторных пациентов с ВП в возрасте от 16 до 88 лет (47,1±17,2 года). Наиболее часто назначаемыми группами ЛС были антибиотики для системного применения (99,5%), препараты для лечения кашля и простуды (75,5%), витамины (24,0%) и антигистаминные ЛС (23,4%). Среди АБП чаще назначали гентамицин (29,3%), котримоксазол (22,7%), ампициллин (20,3%), ципроф локсацин (17,2%). В качестве стартовой у 83,6% пациентов применялась монотерапия (чаще всего гентамици ном 18,7%, ампициллином 14,5%, ципрофлоксаци ном 12,5%), у 16,4% комбинации АБП (ампициллин + котримоксазол 24,4%, гентамицин + котримоксазол 8,7%). Повторные курсы АБП назначались в 24,7% случаев. Средняя продолжительность лечения АБП составила 9,9±4,7 дня. В 28,6% случаев АБП вводили парентерально. Клиническое выздоровление наблюдалось у 74,2% пациентов. Частота госпитализации составила 25,3%. Результаты исследования продемонстрировали значительные отличия реальной практики лечения ВП в амбулаторных условиях от существующих стандартов: необоснованный выбор АБП, нерациональная тактика антибактериальной терапии, применение ЛС с недоказанной при ВП клинической эффективностью [4].
Одной из наиболее распространенных ошибок является назначение препарата, не рекомендованного для лечения пневмонии у определенной категории больных. В первую очередь это касается необоснованного назначения ампициллина при амбулаторном лечении ВП. Следует помнить, что биодоступность ампициллина при приеме внутрь колеблется от 37 до 40%, зависит от приема пищи и от состояния желудочнокишечного тракта. Биодоступность ампициллина максимальна натощак. Всасываемость зависит от приема пища, моторики, кисло тообразования и кровообращения в желудке. Совместный прием антацидов, гастропротекторов, метоклопрамида и циметидина снижает всасывание ампициллина, что приводит к непредсказуемым колебаниям концентрации препарата в плазме и тканях, снижая его антимикробную активность. Другие возможные причины неэффективности терапии АБК представлены в таблице 6.
Для обеспечения большей безопасности следует отдавать предпочтение пероральному введению АБП или своевременному переключению с парентерального пути введения на пероральный (ступенчатая терапия).
Критериями для перехода с парентерального пути введения АБП на пероральный следует считать нормализацию температуры тела при двукратном измерении за последние 16 ч, тенденцию к нормализации числа лейкоцитов, субъективное улучшение самочувствия, отсутствие признаков нарушения всасывания. В идеале на пероральное лечение переходят после 4827часовой парентеральной терапии. Обычно переходят на пе роральную форму того же АБП, однако возможно применение препарата, близкого по антибактериальному спектру к парентеральному АБП. Для обеспечения высокой комплайентности целесообразны АБП с высокой биодоступностью и удобным режимом дозирования (12 раза в сутки).
Стоимость АБП не является решающим фактором в назначении лечения. В то же время использование эффективных антибиотиков, наиболее показанных при данной патологии, ассоциируется с более быстрой положительной динамикой, сокращением длительности антибиотикотерапии и общей продолжительности лечения, что в конечном итоге дает значительный экономический эффект. Относительно более дорогостоящий антибиотик Амоксиклав при сравнении с традиционными препаратами (пенициллином, линкомицином, ампициллином и др.) оказался более экономичным.
В ряде случаев не удается достичь положительного результата. При отсутствии эффекта антибактериальной терапии в течение первых 4872 ч лечения производится замена антибиотика.
Минимальная продолжительность антибиотикотерапии при ВП, вызванных внутриклеточными возбудителями, равна 1014 дням. Основным критерием прекращения антибактериальной терапии считается стойкая апи рексия (34 дня). Сохранение отдельных клинических, лабораторных или рентгенологических признаков заболевания не является абсолютным показанием к продолжению антибактериальной терапии либо ее модификации.
Адекватным ответом лиц без предшествующих заболеваний на антибактериальную терапию считают:
- нормализацию температуры тела: 24 дня (быстрее при S. рпеитошаеинфекции);
- разрешение инспираторной крепитации/влажных хрипов (сохраняется >7 дней у 2040% больных);
- рентгенографическую динамику (у лиц младше 50 лет разрешение пневмококковой пневмонии наблюдается в течение 4 недель в 60% случаев).
Для профилактики возникновения ВП в настоящее время предлагается вакцинация 23валентной пневмококковой вакциной определенных популяций, а именно:
- пациентов с факторами риска;
- всех лиц в возрасте 65 лет и старше с застойной сердечной недостаточностью без иммунологических нарушений;
- всех лиц моложе 65 лет с застойной сердечной недостаточностью, хронической обструктивной болезнью легких (но не бронхиальной астмой), диабетом, алкоголизмом, циррозом печени;
- пациентов с иммуносупрессией, в том числе получающих иммуносупрессивную терапию.
Таким образом, лечение ВП в современных условиях проводится с учетом чувствительности основных возбудителей к АБП, тяжести течения основного заболевания и наличия сопутствующей патологии.
Литература
- Ариэль Б.М., Барштейн Ю.А. Методология изучения пневмонии (опыт двух столетий) // Пульмонология.№ 1. С. 5658.
- Белоусов Ю.Б., Шатунов С.М. Антибактериальная химиотерапия. М., 2001. 473 с.
- Богун Л.В. Антибиотикотерапия при внебольнич ной пневмонии // Клиническая антибиотикотерапия. № 4. С. 510.
- Дворецкий Л.И. Внебольничные пневмонии тяжелого течения. Современные возможности антибактериальной пневмонии // Пульмонология. № 2. С. 123127.
- Козлов Р.С., Кречикова О.И., Сивая О.В. Антимикробная резистентность Streptococcus pneumoniae в России: результаты проспективного многоцентрового исследования (фаза А проекта ПеГАСІ) // Клин. микро биол. и антимикроб. химиотер. № 4. С. 267277.
- Козлов Р.С. От эмпирической терапии к доказательным принципам выбора антибиотика // Здоров’я України. № 21 (130). С. 3839.
- Легнани Д. Роль пероральных антибиотиков в лечении внебольничных инфекций нижних дыхательных путей // Український медичний часопис. № 2 (10). С. 3439.
- Мостовой Ю.М. Пневмония: современное состояние вопроса. Лекция для врачей. Киев, 1998. 28 с.
- Наказ МЗ України № 128 від 03.2007 р. «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Пульмонологія».
- Симонов С.С., Дзюблик А.Я. Современные стандарты лечения в пульмонологии // Здоров’я України. № 8 (98). С. 9.
- Фещенко Ю.І., Дзюблик О.Я., Мостовий Ю.М. та ін. Негоспітальна пневмонія у дорослих. Етіологія, патогенез, класифікація, антибактеріальна терапія: Методичні рекомендації. 47 с.
- Фещенко Ю.И., Яшина Л.А. Новый подход к классификации и лечению пневмоний // Фармновости. № 34. С. 37.
- Чучалин А.Г., Синопальников А.И., Яковлев С.В. и др. Внебольничная пневмония у взрослых: Практические рекомендации по диагностике, лечению и профилактике. М., 2005. 37 с.
- Bosker G., Amin A., Emerman C.L. et al. Antibiotic Selection and OutcomeEffective Management of CommunityAcquired Pneumonia: Year 2005 Update.
- Hedlund J.V., Ortqist A.B., Kalin M.E., Granath F. Factors of importance for the long term prognosis after hospital treated pneumonia. Thorax 1993; 48 (8): 7859.
- Woodhead М., Blasi F., Ewig S. et al. Guidelines for the management of adult lower respiratory tract infections. Eur Respir J 2005; 26: 11381180.











Комментировать