Классификация ацетонемического синдрома у детей, подробная характеристика клинической картины данного состояния, рассмотрены вопросы дифференциальной диагностики. Вопросы терапии, в частности купированию ацетонемического криза и лечению ацетонемического синдрома в межприступный период. Рль препарата Стимол® в комплексной терапии метаболических нарушений при первичном ацетонемическом синдроме у детей.
Волосовец А.П., Кривопустов С.П., Кожина А.Н., Щербинская Е.Н.
Национальный медицинский университет им. А.А. Богомольца, г. Киев
Резюме
В статье приведена классификация ацетонемического синдрома у детей, дана подробная характеристика клинической картины данного состояния, рассмотрены вопросы дифференциальной диагностики. Особое внимание уделено вопросам терапии, в частности купированию ацетонемического криза и лечению ацетонемического синдрома в межприступный период. Показана роль препарата Стимол® в комплексной терапии метаболических нарушений при первичном ацетонемическом синдроме у детей.
В МКБ 10-го пересмотра ацетонемический синдром не выделяется как отдельная нозологическая единица. Однако в практической деятельности педиатр часто встречается с различными нарушениями обмена веществ у детей, которые сопровождаются развитием ацетонемического синдрома. Ацетонемический синдром представляет собой совокупность симптомов, обусловленных повышением в крови кетоновых тел: ацетона, ацетоуксусной кислоты и бета-оксимасляной кислоты — продуктов неполного окисления жирных кислот.
Классификация ацетонемического синдрома:
1. Первичный ацетонемический синдром.
2. Вторичный ацетонемический синдром, который сопровождает:
— декомпенсированный сахарный диабет;
— гиперинсулинизм;
— инсулиновую гипогликемию;
— гликогеновую болезнь;
— тиреотоксикоз;
— инфекционный токсикоз;
— черепно-мозговые травмы;
— опухоли мозга в области турецкого седла;
— болезнь Иценко — Кушинга;
— лейкемию;
— гемолитическую анемию;
— голодание;
— другие состояния.
Первичный ацетонемический синдром рассматривается отечественными педиатрами как периодические ацетонемические кризы у детей, которые характеризуются гиперурикемией, гиперкетонемией, ацетонурией и ацидозом. Постоянный спутник ацетонемического синдрома — многократная рвота. В происхождении ацетонемического синдрома ведущая роль отводится особенностям обмена веществ, низкой ацетилирующей способности ацетилкоэнзима А (ацетил-КоА), тенденции к гиперурикемии, повышенной возбудимости и быстрой истощаемости нервной системы, нарушениям эндокринной регуляции.
Вторичный ацетонемический синдром наиболее часто возникает у детей при различной сочетанной патологии желудочно-кишечного тракта, сопровождающейся симптомами интоксикации, холестаза, токсического поражения печени, а также нарушениями микрофлоры кишечника. Клиническая картина ацетонемического синдрома в таких случаях определяется основным заболеванием, на которое наслаивается кетонемия.
Известно, что при усиленном липолизе избыток свободных жирных кислот (СЖК) поступает в печень, где они трансформируются в «универсальный» метаболит — ацетил-КоА. При нормальном обмене основным путем метаболизма ацетил-КоА является реакция с оксалоацетатом и дальнейшее участие в цикле Кребса с образованием энергии. Часть ацетил-КоА используется для ресинтеза жирных кислот и выработки холестерина по оксиметилглютариловому пути. Только небольшое количество ацетил-КоА идет на образование кетоновых тел. При усилении же липолиза количество ацетилКоА избыточно, кроме того, ограничено его поступление в цикл Кребса в связи с уменьшением количества оксалоацетата. При этом также снижается активность ферментов, активирующих образование холестерина и СЖК. В результате остается один путь утилизации ацетил-КоА — кетогенез.
На первом этапе посредством конденсирования двух молекул ацетил-КоА образуется ацетоацетил-КоА, который метаболизируется в ацетоуксусную кислоту, а та, в свою очередь, может легко переходить в два других вида кетоновых тел — ацетон и бета-оксимасляную кислоту.
Кетоз влечет за собой ряд неблагоприятных последствий для организма ребенка. Возникает метаболический ацидоз, компенсация которого в начальной стадии осуществляется за счет гипервентиляции, последствием чего является гипокапния, вызывающая вазоконстрикцию, в том числе сосудов головного мозга. Избыток кетоновых тел оказывает негативное воздействие на центральную нервную систему, вплоть до развития комы. Следует помнить, что ацетон является жирорастворителем, который повреждает липидный бислой клеточных мембран. Более того, для утилизации кетоновых тел требуется дополнительное количество кислорода, что может усугублять несоответствие между его доставкой и потреблением.
За рубежом рассматриваемое состояние определяют как отдельное заболевание, называемое синдромом циклической рвоты (Cyclic Vomiting Syndrom — CVS). Прошло много времени с тех пор, когда известный педиатр Samuel Ge в 1882 году описал его, но патогенез CVS окончательно не изучен. Высказываются точки зрения, что CVS — полиэтиологическое заболевание, в основе которого лежат нарушения гипоталамо-гипофизарнонадпочечниковой системы c повышением секреции кортикотропин-рилизинг фактора и нарушением вегетативной регуляции. Не вызывает сомнения генетическая близость CVS и мигрени. Выявлено сходство гормональных изменений при CVS и менструальных головных болях. Перспективными считаются представления о CVS как о «митохондриальной болезни».
В отечественной педиатрии рассмотрение данной проблемы связывают с особенностями нервно-артритической аномалии конституции (НААК), которая на сегодняшний день рассматривается как энзимодефицитное состояние, характеризующееся:
— повышенной возбудимостью и быстрой истощаемостью нервной системы на всех уровнях рецепции с наличием доминантного очага застойного возбуждения в гипоталамо-диэнцефальной области;
— недостаточностью ферментов печени — глюкозо-6-фосфатазы, гипоксантин-гуанинфосфорибозилпирофосфатсинтетазы;
— низкой ацетилирующей способностью ацетилкоэнзима А вследствие дефицита щавелевой кислоты, необходимой для вовлечения последнего в цикл Кребса;
— нарушением механизма повторного использования мочевой и молочной кислот;
— нарушением жирового и углеводного обмена;
— нарушением эндокринной регуляции метаболизма.
Дети с НААК отличаются повышенной возбудимостью, эмоциональной лабильностью, нарушением сна, пугливостью, возможна аэрофагия и пилороспазм. К годовалому возрасту они обычно заметно отстают в массе от сверстников, но нервнопсихическое их развитие, напротив, опережает возрастные нормы, дети быстро овладевают речью, проявляют любознательность, интерес к окружающему, хорошо запоминают и пересказывают услышанное, однако часто в поведении проявляют упрямство и негативизм.
Начиная с 2–3-летнего возраста у них отмечаются преходящие боли в суставах, абдоминальные боли спастического характера, дискинезия желчевыводящих путей, непереносимость запахов, мигрень, салурия с преимущественной уратурией, ацетонемические кризы. Развитию последних может способствовать множество факторов, которые в условиях повышенной возбудимости нервной системы воздействуют стрессогенно: физическое или психоэмоциональное напряжение, гиперинсоляция, пищевые погрешности (например, большое содержание жиров).
Ацетонемические кризы возникают внезапно или после предвестников (ауры), к которым можно отнести анорексию, вялость, возбуждение, мигренеподобную головную боль, тошноту, абдоминальные боли преимущественно в околопупочной области, ахоличный стул, запах ацетона изо рта.
Исторически известно, что термин «диатез» происходит от греческого слова «расположение, состояние», а понятие «нервно-артритический диатез» (Diathesis neuroarthritica) в педиатрию ввел в 1901–1902 годах Дж. Комби как состояние, которое«характеризуется повышенной нервной возбудимостью, расстройствами питания, склонностью к кетоацидозу, а в дальнейшей жизни предрасположенностью к развитию ожирения, интерстициального нефрита, нефрокальциноза, подагры и обменных артритов, что обусловлено в основном нарушениями пуринового обмена».
В настоящее время в современной англоязычной литературе термин «диатез» не используется. Следует признать, что мы все склонны к каким-то определенным болезням, которые обусловлены совокупностью генетических факторов, но для того, чтобы это определить, нужен фундаментальный генетический анализ. Диатез — это не болезнь, а предрасположенность к чему-то, при этом клинически значимые проявления отсутствуют. Предрасположенность к чему-то не нужно лечить и ее нельзя вылечить, а необоснованное использование лекарственных средств при этом чревато различными осложнениями. К тому же для интеграции в европейское и мировое профессиональное сообщество и статистическую базу нецелесообразно использовать термины, которые не используются и не понимаются в мире. Термин «диатез» в начале ХХ столетия действительно способствовал развитию педиатрической науки, однако теперь он имеет только историческое значение.
Римские критерии III (2006) в классификации функциональных расстройств системы пищеварения четко определяют специальную педиатрическую рубрику: H. Функциональные расстройства: дети и подростки. H1b. Синдром циклической рвоты.
В классических работах Samuel Ge диагноз CVS основывался на выявлении триады: 1) приступы рвоты, наблюдающиеся 3 и более раза, 2) чередование приступов CVS с периодами полного здоровья, 3) стереотипный характер эпизодов по времени возникновения, клиническим особенностям и длительности. В настоящее время предложены критерии диагностики CVS.
Диагностические критерии CVS:
Обязательные симптомы:
— минимум 3 типичных рецидивирующих тяжелых приступа рвоты и/или тошноты и рвоты;
— более чем четырехкратная рвота в фазе разгара заболевания;
— эпизоды длительностью от нескольких часов (в среднем 24–48 часов), минимум 2 часа, но иногда до 10 дней и более;
— частота приступов менее 2 эпизодов в неделю, в среднем каждые 2–4 недели;
— периоды совершенно нормального самочувствия различной длительности;
— отсутствие очевидной причины рвоты при обследовании.
Дополнительные критерии:
— стереотипность: для конкретного пациента каждый эпизод подобен по времени начала, интенсивности, продолжительности, частоте, ассоциированным признакам и симптомам;
— возможность самоликвидации: приступы могут завершаться спонтанно и без лечения;
— анамнез: случаи мигрени или CVS в семье;
— анамнестические данные о необходимости внутривенного введения жидкости в течение приступа;
— дополнительные симптомы (не у всех больных): рвота с примесью желчи, тошнота, боль в животе, головная боль, неприятные ощущения во время движения, повышенная чувствительность к свету и шуму.
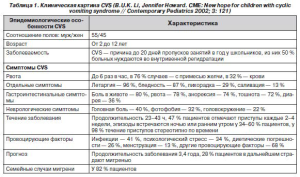
B.U.K. Li, Jennifer Howard (2002) обобщили данные о клинической картине CVS (табл. 1).
Клиническая картина ацетонемического криза:
— многократная или неукротимая рвота в течение 1–5 дней (попытка напоить или покормить ребенка провоцирует рвоту);
— наличие в моче, рвотных массах, выдыхаемом воздухе ацетона;
— дегидратация;
— интоксикация (бледность кожи с характерным румянцем, гиподинамия, мышечная гипотония);
— беспокойство и возбуждение в начале криза сменяются вялостью, слабостью, сонливостью, в редких случаях возможны судороги, в тяжелых случаях при отсутствии адекватной терапии может развиться ацетонемическая кома;
— гемодинамические нарушения (гиповолемия,ослабление сердечных тонов, тахикардия, аритмия);
— спастический абдоминальный синдром (схваткообразные или упорные боли в животе, тошнота, задержка стула);
— увеличение печени на 1–2 см, сохраняющееся в течение 5–7 дней после купирования криза;
— повышение температуры тела до 37,5–38,5°С;
— наличие в крови повышенной концентрации кетоновых тел;
— гипохлоремия, метаболический ацидоз, гипогликемия, гиперхолестеринемия, беталипопротеидемия;
— в периферической крови умеренный лейкоцитоз, нейтрофилез, умеренное повышение СОЭ.
Однако при установлении диагноза ацетонемического синдрома или CVS всегда нужно помнить о дифференциальной диагностике и диагнозах исключения, при этом учитывать:
— кишечные инфекции;
— аппендицит;
— сахарный диабет;
— дисметаболические заболевания почек;
— другие заболевания почек (гидронефроз и др.);
— панкреатит;
— аномалии желудочно-кишечного тракта;
— патологию ЦНС (опухоли, эпилепсия и др.);
— побочные действия медикаментов;
— отравления;
— психогенные факторы;
— надпочечниковую недостаточность;
— другие заболевания обмена веществ.
При проведении дифференциальной диагностики синдрома циклической ацетонемической рвоты следует прежде всего исключить острую хирургическую патологию и кишечные инфекции, которые требуют бактериологического и вирусологического обследования. Дети с синдромом циклической ацетонемической рвоты рассматриваются в качестве группы риска по возникновению сахарного диабета, в связи с чем подлежат диспансерному наблюдению у эндокринолога. При наличии кристаллурии определяют суточную экскрецию солей с мочой, проводят другие исследования в рамках диагностики дисметаболического поражения почек. В ряде случаев при упорной рвоте необходимо исключить надпочечниковую недостаточность (аддисонический криз). Также необходимо помнить, что эпилепсия в детском возрасте характеризуется значительным полиморфизмом припадков, которые могут проявляться и ацетонемической рвотой.
Лечение CVS в англоязычной литературе основано на представлении о четырех последовательных фазах CVS: начало приступа, приступный период, период восстановления и межприступный период. Фаза ауры, во время которой пострадавший уже знает, что эпизод приближается, но все еще способен принимать лекарства через рот, может длиться от нескольких часов до нескольких минут или же отсутствовать вовсе. Эту особенность CVS рекомендуют использовать для проведения превентивных мероприятий, у ряда пациентов может быть полезным применение нестероидного противовоспалительного средства (ибупрофена), ингибитора протонной помпы или Н2-блокатора. Иногда предотвращает рвоту назначение ондансетрона. В том случае, если начало заболевания сопровождается головной болью, может быть эффективным суматриптан.
В целом лечение ацетонемического синдрома можно разделить на два этапа: купирование ацетонемического криза и проведение в межприступный период мероприятий, которые направлены на профилактику рецидивов.
Купирование ацетонемического криза:
— каждые 10–15 мин поить ребенка негазированной щелочной минеральной водой, сладким чаем с лимоном, растворами для пероральной регидратации;
— очистить кишечник 1–2% раствором гидрокарбоната натрия;
— по показаниям — инфузионная терапия (внутривенная гидратация);
— ондансетрон — селективно блокирует серотониновые 5-НТ3-рецепторы в ЦНС;
— другие лекарственные средства (Стимол® и др.);
— постепенное расширение диеты.
Задачи инфузионной терапии: нормализация объема, состава и свойств экстрацеллюлярной и интрацеллюлярной жидкости, детоксикация, проведение парентерального питания. Как правило, при ацетонемической рвоте дегидратация вначале изотоническая, но позже становится гипотонической. Инфузионная терапия проводится в режиме регидратации. Программа регидрационной терапии должна учитывать: определение суточной потребности в жидкости и электролитах, определение типа и степени дегидратации, определение дефицита жидкости, определение текущих потерь жидкости. В качестве инфузионных растворов используются 5–10% раствор глюкозы, 0,9% раствор натрия хлорида, раствор Рингера с учетом показателей водноэлектролитного обмена. Если ребенок пьет охотно достаточное количество жидкости, парентеральное введение инфузионных растворов может быть полностью или частично заменено пероральной регидратацией.
При упорной неукротимой рвоте показано назначение метоклопрамида парентерально, который блокирует дофаминовые рецепторы в триггерной зоне рвотного центра. Учитывая возможные нежелательные побочные эффекты со стороны нервной системы, введение метоклопрамида более 1–2 раз не рекомендуется. На фоне инфузионной терапии рекомендуют ондансетрон внутривенно, который селективно блокирует серотониновые 5-НТ3-рецепторы в ЦНС.
В периоде восстановления отмечается повышение активности ребенка, восстановление аппетита, нормализация цвета кожи, возвращаются положительные эмоции. В этот период рекомендуется постепенное восстановление водно-солевого баланса естественным путем и осторожное расширение диеты. Необходимо давать достаточное количество жидкости, диету следует расширять очень постепенно, ребенок должен есть небольшими порциями, не меньше 5–6 раз в день. Разрешаются сухарик (желательно домашнего приготовления), галетное печенье, печеное яблоко, затем картофельное пюре (на воде, затем можно добавить немного сливочного масла), каши, нежирные овощные супы, нежирная говядина (не телятина, которая содержит много пуринов, как и мясо птицы), отварной картофель, каши (кроме пшенной и перловой), некрепкий чай, некислые фрукты и ягоды, а также отвары из них.
Диета при этом должна удовлетворять следующим условиям:
— в рационе должно содержаться достаточное количество жидкости;
— необходимо «разгрузить» цикл Кребса. Из рациона следует исключить все жиры и экстрактивные вещества, химические добавки к пище. Растительный и рыбий жиры легче, чем животный жир, всасываются в кишечнике, но содержат ненасыщенные жирные кислоты, перегружающие цикл Кребса, а потому должны быть исключены из рациона в первую очередь;
— должна поддерживаться щелочная реакция мочи. Следует ограничить кислые продукты — отвар шиповника, красную смородину, киви и др.;
— избыток калия в пище приводит к повышенной экскреции его с мочой. Поскольку диффузия калийных солей органических кислот заметно меньше натриевых, возможно замедление выведения кетокислот. Таким образом, следует ограничить прием продуктов, содержащих много калия (бананы, абрикосы, печеный картофель);
— продукты, усиливающие газообразование в кишечнике (бобовые, черный хлеб, капуста, редька) и раздражающие слизистую кишечника (лук, чеснок, хрен и др.), могут усилить кишечную дискинезию и должны быть исключены из рациона.
В последние годы накоплен положительный клинический опыт применения метаболического препарата Стимол® (BIOCODEX, Франция) в коррекции первичного ацетонемического синдрома у детей.
Стимол® (малат цитруллина) — противоастенический препарат, действие которого направлено на коррекцию метаболических нарушений (гиперлактатемии и гипераммониемии) при различной патологии.
Малат — дикарбоновая кислота, нормализующая работу цикла Кребса, уменьшает уровень лактата в крови и тканях, предупреждает развитие молочнокислого ацидоза, усиливает метаболизм, способствует синтезу 38 молекул АТФ и является основным поставщиком энергии для метаболических процессов.
Цитруллин — аминокислота, активирующая образование и выведение аммиачных соединений из организма, играет важную роль в орнитиновом цикле аммиака. Малат помогает обойти аммиачный блок окислительного пути и ограничить накопление молочной кислоты путем переориентации его в сторону глюконеогенеза, а цитруллин, как промежуточный продукт цикла мочевины, ускоряет этот цикл и усиливает выведение NH4. Стимол®, улучшая работу цитохромоксидазной системы (цитохром Р450), также усиливает детоксикационную функцию печени.
В последние годы появилось много публикаций, посвященных применению Стимола® у взрослых с различной патологией. Препарат включают в схемы лечения хронических заболеваний у ликвидаторов аварии на ЧАЭС, артериальной гипотензии и «мягкой» гипертензии, в комплексную терапию алкогольного абстинентного синдрома, для коррекции метаболизма при лечебном голодании, для преодоления физической усталости у спортсменов, при астении у пожилых больных, в процессе выздоровления после инфекционных заболеваний, оперативных вмешательств, длительной иммобилизации.
В педиатрии известны работы о применении Стимола® для коррекции астенометаболических нарушений у детей с нефротическим синдромом, при вторичной метаболической кардиомиопатии, астении различного генеза, в том числе постинфекционной, железодефицитной анемии, мышечных дистрофиях и амиотрофиях, головной боли перенапряжения (С.С. Казак, 2005; И.В. Киреев, 2005; А.П. Волосовец, 2006; С.Л. Няньковський, 2006; С.П. Кривопустов, 2006; Ю.В. Марушко, 2008; С.А. Крамарев, 2008; С.К. Евтушенко, 2008; С.Л. Няньковский, 2008; Д.Д. Иванов, 2008 и др.).
Особый интерес представляет работа, выполненная проф. В.В. Бережным, доц. Л.В. Курило и проф. Т.В. Марушко на кафедре педиатрии № 2 Национальной медицинской академии последипломного образования им. П.Л. Шупика (2007–2008), целью которой было изучение эффективности Стимола® при ацетонемическом синдроме у детей во время криза.
Под наблюдением находилось 22 ребенка с ацетонемическим синдромом в периоде обострения. 1-ю группу составили 15 детей, которым наряду с базисной терапией назначали Стимол® в общепринятых терапевтических дозах в течение 10 дней. 2-ю группу составили 7 детей, получавших только базисную терапию. Наряду с общеклиническим обследованием определялись следующие показатели: холестерин, липопротеины низкой плотности, триглицериды, лактат, калий, натрий, кетоновые тела в моче.
Терапевтическая эффективность Стимола® определялась путем оценки регрессирования клинических, метаболических, электролитных нарушений, учитывали, в частности, частоту рвоты, интенсивность абдоминальных болей и диспептических расстройств, степень метаболических и электролитных сдвигов, нарушение сознания, ацетонурию.
Проведенные исследования показали, что у 10 детей 1-й группы тяжесть клинического течения ацетонемического криза оценивалась преимущественно в 2–3 балла, регрессирование метаболических и электролитных нарушений отмечено в течение 3 дней. У 5 детей 1-й группы, поступивших в стационар с клиническим симптомокомплексом в 4–5 баллов, регрессирование метаболических и электролитных нарушений составило 4–5 дней. У детей 2-й группы тяжесть клинического симптомокомплекса составила 2–4 балла, регрессирование клинических и метаболических сдвигов — 5–7 дней. Это было клинически подтверждено и в клинике кафедры педиатрии и медицинской генетики № 2 Национального медицинского университета им. А.А. Богомольца.
Таким образом, использование Стимола® у детей с ацетонемическим синдромом во время криза оказывает выраженный положительный терапевтический эффект, который проявляется снижением продолжительности криза, более быстрым регрессированием метаболических и электролитных нарушений.
Лечение ацетонемического синдрома в межприступный период направлено на профилактику рецидивов ацетонемических кризов.
Важное значение имеют соблюдение режима дня, достаточное пребывание на свежем воздухе, регулярные физические нагрузки без переутомления, водные процедуры (плавание, контрастный душ, обливание), продолжительный сон (не менее 8 часов), витаминизированное питание, следует избегать гиперинсоляции, сократить время просмотра телевизора и работы с компьютером. При значительной урикемии и урикозурии назначаются препараты, нормализующие содержание мочевой кислоты. При назначении ферментотерапии необходимо оценить состояние внешнесекреторной функции поджелудочной железы и назначать энзимы лишь по обоснованным показаниям.
Прогноз. Несмотря на то что приступы ацетонемической рвоты у детей обычно прекращаются после 10–12 лет, всегда следует учитывать вероятность трансформации данного состояния в тяжелую соматическую патологию.
Таким образом, ацетонемический синдром (синдром циклической рвоты) относят к актуальным проблемам современной педиатрии. Представляется целесообразным использование современной терминологии для обозначения данной патологии с учетом Римских критериев III (2006). Особое внимание следует уделять вопросам дифференциальной диагностики и патогенетически обоснованному лечению, которое должно быть максимально индивидуализированным и учитывать период заболевания.
Терапевтический акцент в период купирования криза должен быть сделан на гидратации пациента и рациональном использовании лекарственных средств, среди которых показал высокую эффективность препарат Стимол® (малат цитруллина).
Литература
1. Бережной В.В., Курило Л.В., Марушко Т.В., Капичена М.А. Эффективность метаболической коррекции ацетонемического синдрома у детей // Современная педиатрия. — 2009. — № 5 (27).
2. Бережной В.В., Курило Л.В. Метаболическая коррекция при первичном ацетонемическом синдроме у детей // Матеріали науково-практичної конференції з міжнародною участю «Проблемні питання метаболічних розладів у дітей та підлітків». Національна медична академія післядипломної освіти імені П.Л. Шупика, 20–21 вересня 2007 р., м. Київ.
3. Бережний В.В., Курило Л.В. Метаболічна корекція у дітей з ацетонемічним синдромом / Інформаційний лист № 12-2008 про нововведення в системі охорони здоров’я.
4. Евграфова Н.Б., Квашнина Л.В. Особенности функционального состояния поджелудочной железы у детей с ацетонемическим синдромом в разные возрастные периоды // Medicus Amicus. —2002. — № 5.
5. Евтушенко С.К., Шаймурзин М.Р., Евтушенко Л.Ф., Евтушенко И.С., Лепихов П.А., Сохань Д.А. Стимол и синглетный кислород в комплексной терапии прогрессирующих мышечных дистрофий и амиотрофий с сочетанной кардиомиои пневмопатией у детей и подростков // Международный неврологический журнал. — 2008. — № 4(20). — С.72-80.
6. Закирова Р.А., Кузнецова Л.А. Кетоацидоз у детей // Казанский медицинский журнал. —1988. — № 1.
7. Казак С.С., Бекетова Г.В. Діагностика та дієтотерапія ацетонемічного синдрому у дітей // Ліки України. — 2005. — № 1.
8. Крамарев С.А., Выговская О.В., Палатная Л.А. Возможности коррекции астенического синдрома при хронической вирусной инфекции Эпштейна — Барр // Здоров’я України. — 2008. —№ 3(183). — С. 62-63.
9. Кривопустов С.П. Применение препарата Стимол® при астении в практике современной педиатрии // Новости медицины и фармации. — 2006.— № 1–2.
10. Курило Л.В. Первичный ацетонемический синдром у детей // Medicus Amicus. — 2002. —№ 4.
11. Марушко Ю.В., Лисоченко О.О. Метаболічні препарати в лікуванні залізодефіцитної анемії у дітей // Здоров’я України. — 2008. — №18/1. — С. 56-57.
12. Сапа Ю.С. Синдром циклической ацетонемической рвоты // Здоровье Украины. — 2001, июль.
13. Сапа Ю.С. Синдром циклической рвоты у детей: «terra incognita», или Золушка отечественной педиатрии // Medicus Amicus. — 2006. — № 2.
14. Li B.U.K., Jennifer Howard. CME: New hope for children with cyclic vomiting syndrome // Contemporary Pediatrics. — 2002. — 3. — 121.
15. Boles R., Powers A., Adams K. Cyclic Vomiting Syndrome Plus // J. Child Neuro. — 2006. —21(3).
16. Brown J., Li B. Recurrent Vomiting in Children // Clinical Perspectives in Gastroenterology. —2002. — 5.
17. Chepyala P., Svoboda R.P., Olden K.W. Treatment of cyclic vomiting syndrome // Curr. Treat. Options Gastroenterol. — 2007. — 10(4).
18. Forbes D., Fairbrother S. Cyclic nausea and vomiting in childhood // Aust. Fam. Physician. —2008. — 37(1-2).
19. Nelson Textbook of Pediatrics / Robert M. Kliegman, Richard E. Behrman, Hal B. Jenson, Bonita F. Stanton. — 18th edition. — Saunders, 2007.
20. Weinstein M. Underlying Disorders In Cyclic Vomiting Syndrome // Clinical Pediatrics. — 2005.— 44(9).




Комментировать