С.В. Мальцев, В.П. Лакатош, Е.М. Корнилина, Л.М. Лазаренко, О.Ю. Костенко, В.В. Газий Национальный медицинский университет им. А.А. Богомольца
В представленном материале отражены основные изменения клеточного и гуморального иммунитета у женщин с невынашиванием беременности на фоне энтеровирусной инфекции. Проведено сравнение иммунологических изменений у женщин с невынашиванием беременности на фоне энтеровирусной инфекции и без нее.
Ключевые слова: энтеровирусное инфицирование, клеточный и гуморальный иммунитет. Невынашивание беременности продолжает оставаться чрезвычайно важной и значимой проблемой в современном акушерстве и гинекологии. Частота невынашивания в Украине, по данным МЗ, за 2006 г. составляла 15-23% от всех исходов беременности. В настоящее время пересмотрено отношение к различным формам невынашивания беременности. На сегодняшний день под преждевременными родами понимают роды со спонтанным началом, прогрессированием родовой деятельности и рождением плода с массой более 500 г в срок беременности с 22 по 37 нед гестации (согласно приказу №676 МЗ Украины от 31.12.2004). Анализ этиологической структуры невынашивания беременности позволяет предположительно распределить влияние основных причин в зависимости от срока беременности. Прерывание беременности до 5-6 нед чаще всего обусловлено генетическими и иммунологическими нарушениямианомалиями кариотипа эмбриона, степенью совместимости антигенов родителей по системе гистосовместимости (HLA), индивидуальным повышением в организме матери уровней NK и провоспалительных цитокинов. Абортивный исход в сроке 7-9 нед в основном связан с гормональными нарушениямис недостаточностью лютеиновой фазы любого генеза, гиперандрогенией (надпочечниковой, яичниковой, смешанной), сенсибилизацией к гормонам (появление антител к ХГ, прогестерону). При прерывании беременности в 10-16 нед на первый план выступают такие причины, как различные аутоиммунные нарушения, в том числе антифосфолипидный синдром (АФС), а также тромбофилические нарушения иного генеза (наследственная тромбофилия, избыток гомоцистеина и др.). Инфекция, истмико-цервикальная недостаточность, тромбофилические нарушения, приводящие к развитию плацентарной недостаточности и тяжелым осложнениям беременности (к отслойке плаценты, задержке внутриутробного развития плода, гестозам и др.), являются факторами риска невынашивания после 16 нед беременности [1, 3, 7]. Среди многообразия причин невынашивания значительная роль принадлежит инфекции. Внутриутробное инфицирование плода является одним из определяющих факторов антенатальной, интранатальной и постнатальной его гибели и обусловливает значительный процент случаев прерывания беременности как в ранние, так и в более поздние сроки. Особый интерес в этой связи вызывают вирусные инфекции. Вирусы способны проникать через плаценту, а при аутоиммунных заболеваниях, гестозах, угрозе прерывания беременности трансплацентарный переход вирусов осуществляется практически беспрепятственно. Иммуносупрессивный эффект вирусов объясняет их инвазию и феномен персистенции в организме женщины. Тропность вирусов к тканям с высоким уровнем метаболизма обусловливает их массивное проникновение в быстро делящиеся клетки эмбриона, которые являются идеальной средой для репликации вирусных частиц. Вирусная диссеминация не может не приводить к изменениям в иммунной системе, системе интерферонов, цитокиновому дисбалансу. Вирусная антигенемия и способность к гетерогонизации структур клеточных мембран очень часто является пусковым механизмом возникновения аутоиммунных нарушений. Доказанная цитодеструктивная активность многих вирусов в отношении эндотелиоцитов может провоцировать гиперкоагуляционные изменения, которые характерны для хронического ДВС-синдрома. Среди всех вирусных инфекции наименее изучена этиологическая взаимосвязь энтеровирусов и невынашивания беременности [11] . Данные об изменениях клеточного и гуморального иммунитета представляют особый интерес для понимания патогенетического механизма невынашивания, особенно на фоне вирусной инфекции. В первые недели беременности популяция лимфоцитов децидуальной ткани, особенно локализирующаяся в зоне будущей имплантации, представлена на 80% CD56+ NK-клетками (среди них превалируют CD56+CD16-/CD3-, большие гранулярные лимфоциты БГЛ), Т-лимфоцитами CD 3+ около 10% и Cd14+ (макрофагами) приблизительно 9-10%. БГЛ вырабатывают пептид трансформирующий фактор роста, который подавляет активацию и пролиферацию цитотоксических клеток [3, 5]. На больших гранулярных клетках имеется два вида рецепторовKIR, контакт с которыми ведет к блокированию цитотоксических реакций, и KAR, активация которых способствует запуску каскада реакций, приводящих к отторжению трофобласта [9]. HLAG-антиген, экспрессируемый трофобластом, распознается KIRрецепторами и при этом цитотоксические реакции выключаются. Большая роль для нормального развития беременности, особенно на ранних сроках, принадлежит белку TJ6, который синтезируется лимфоидной тканью децидуальной оболочки. Этот протеин, связываясь с рецепторами цитотоксических NK-клеток, вызывает их апоптоз. Прогестерониндуцированный блокирующий фактор (PIBF), синтез которого катализируется эндогенным прогестероном, направляет иммунный ответ матери на эмбрион в сторону менее активных NK-клеток больших гранулярных лимфоцитов, а через их KIR-рецепторы иммунная реакция осуществляется по ^2-пути (посредством регуляторных цитокинов) [12]. Поэтому чрезвычайно важным фактором, определяющим нормальное протекание беременности, считается преобладание регуляторных ^2-цитокинов. Эта группа цитокинов (ИЛ-3, ИЛ-4, ИЛ-10, ИЛ-13, колониестимулирующий фактор гранулоцитов и макрофагов, лейкемия-ингибирующий фактор), секретируемых лимфоцитами CD4+ 2-го типа, стимулирует рост и дифференцировку клеток трофобласта на внутренний слой цитотрофобласт и наружный синцитиотрофобласт [10]. На протяжении всей беременности (с самого ее начала) абсолютное количество Т-лимфоцитов (CD 3) и их основных разновидностей (CD 4 и CD 8) уменьшается, но это не свидетельствует о развитии иммунодефицита во время беременности. Супрессия специфического звена иммунного ответа в гравидарный период компенсируется активацией системы естественного иммунитета. Мобилизация системы неспецифической резистентности (естественного иммунитета) характеризуется увеличением количества моноцитов и гранулоцитов, что и обеспечивает защиту организма беременной от большинства бактериальных инфекций. Однако этого бывает недостаточно для элиминации внутриклеточных возбудителей, особенно вирусов. Поэтому вирусные инфекции могут протекать тяжелее, чем вне беременности. С другой стороны, гиперактивация системы естественного иммунитета во время беременности может послужить пусковым механизмом для гиперпродукции провоспалительных цитокинов, которые напрямую или опосредовано могут приводить к абортивному исходу беременности [3, 7, 9, 13]. Учитывая вышесказанное, очевидно, что в основе невынашивания беременности лежат иммунные реакции на гуморальном и клеточном уровне. Поэтому проведение иммунологических исследований обязательно для женщин с невынашиванием, ассоциированным с энтеровирусной инфекцией. Цель работы изучить состояние клеточного и гуморального звеньев иммунитета у женщин с невынашиванием беременности на фоне энтеровирусной инфекции и при ее отсутствии.
МАТЕРИАЛЫ И МЕТОДЫ
В условиях КГКБ № 18 были обследованы 59 женщин с невынашиванием беременности. Пациентки были разделены на 2 группы1-я группа 29 женщин с невынашиванием беременности и диагностированной энтеровирусной инфекцией, 2-я группа 30 пациенток, у которых энтеровирусы не были выявлены. Контрольную группу составили 30 здоровых женщин после искусственного прерывания беременности. В обеих группах самопроизвольное прерывание беременности происходило в сроки 10-20 нед. Детекцию энтеровирусов в 1-й группе производили в осадке мочи при помощи полимеразной цепной реакции (ПЦР). Для проведения данного исследования использовали коммерческие тест-системы АмплиСенс 100Р (Россия), выделение РНК вирусов осуществляли при помощи набора для выделения РНК РИБО-сорб (Россия). Материалом для иммунологических исследований была периферическая кровь. Фагоцитарную активность моноцитов (Мц) и нейтрофильных гранулоцитов (Нф) определяли в тесте с частицами латекса (1,5 мкм) по методу Т.И. Ивчик [4], их бактерицидную активность в тесте с нитросиним тетразолием (НСТ) с определением функционального резерва, который рассчитывали по разнице спонтанного и стимулированного пирогеналом (1,25 мкг/мл) НСТтестов [13]. Уровень циркулирующих иммунных комплексов (ЦИК) определяли по методу Digeon[8], уровень сывороточных иммуноглобулинов A, M, Gпо Mancini[10]. Фенотипирование лимфоцитов с антигенными поверхностными маркерами CD3 (Т-лимфоциты), CD4 (Т-хелперы), CD8 (Т-супрессоры/ цитотоксические лимфоциты), CD16 (натуральные киллеры), CD19 (В-лимфоциты), CD25 (рецептор для ИЛ-2 на активированных клетках), CD3+/HLA-DR+ (активированные Т-лимфоциты), CD3-/HLA-DR+ (активированные В-лимфоциты) проводили на приборе FACSCAN (BectonDickinson, (США) с использованием моноклональных антител фирмы «Caltag» (США) согласно инструкции производителя. Статистическую обработку результатов проводили стандартными методами вариационной статистики с применением программы Statistica 6.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
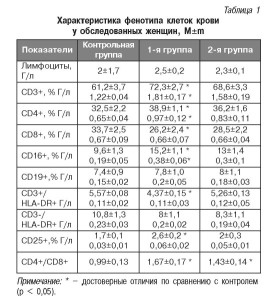
При изучении фенотипа мононуклеарных клеток периферической крови было выявлено повышение экспрессии поверхностных антигенов у пациенток 1-й группы (верифицирована энтеровирусная инфекция) по сравнению с аналогичными показателями у женщин контрольной группыувеличение относительного и абсолютного количества Т-лимфоцитов (CD3+), Т-хелперов (CD4+) и природных киллеров (CD16+) (табл. 1). Относительное количество Т-супрессоров/ цитотоксических клеток у женщин 1 -й группы было снижено по сравнению с контролем на 22%. Степень активации Ти В-лимфоцитов определяли по количеству клеток с HLA-DR-рецепторами. Было установлено уменьшение их экспрессии на Тлимфоцитах и незначительное снижение на Влимфоцитах. Наиболее существенное снижение относительного количества CD3+/HLA-DR+ клеток по сравнению с контрольными показателями наблюдалось у пациенток 1 -й группы. У женщин 1-й группы было увеличено (на 52,9% по сравнению с нормой) количество лимфоцитов с активационным маркером CD25 рецептором для ИЛ-2, который является необходимым ростовым фактором для различных субпопуляций Т-клеток. Связывание ИЛ-2 с рецепторами активированных Тлимфоцитов индуцирует их пролиферацию и способность к продукции цитокинов. Таким образом, существенное увеличение количества Ой25+-клеток свидетельствует об активации лимфоцитов, а связывание с ИЛ-2 способствует дальнейшей активации NК-клеток и макрофагов. Возрастание количества клеток с антигенами CD3, Ой4, CD16 в обеих группах наблюдения, но в большей степени у пациенток с диагностированной энтеровирусной инфекцией свидетельствует о гиперактивации иммунитета при дополнительном бактериальном или вирусном воздействии. Наибольшее снижение количества CD8+-лимфоцитов у пациенток 1-й группы приводило к более существенному увеличению иммунорегуляторного индекса CD4+/CD8+. Анализ функциональной активности фагоцитов у пациенток 1-й группы выявил значительное снижение фагоцитарной способности как моноцитов, так и нейтрофилов, а также уменьшение кислородзависимого метаболизма моноцитов и мобилизацию ферментативно-метаболической активности нейтрофилов, что подтверждает наличие воспалительного процесса, а также цитотоксическое и цитопатическое действие вирусов в отношении фагоцитов и как результат угнетение их фагоцитарной активности, а как следствие прогрессирование нарушений клеточной кооперации в индукции полноценного и эффективного иммунного ответа. При изучении гуморального звена иммунитета выявлены следующие особенностиу женщин 1-й группы отмечено возрастание уровня ЦИК в сыворотке крови по сравнению с контролем на 18,8%, а у пациенток 2-й группы на 12,6% (табл. 3). При исследовании содержания иммуноглобулинов (А, М, G) выявлено следующееуровень IgG существенно не отличался от нормы у женщин обеих групп; содержание сывороточного 1дА было значительно снижено у женщин и 1-й, и 2-й группы. Уровень 1дМ достоверно превышал контрольный показатель (на 62,7% и 51,2% соответственно у женщин 1-й и 2-й групп). Таким образом, увеличение уровня ЦИК, IgG и 1дМ в сыворотке крови у пациенток с невынашиванием свидетельствует о развитии патологического воспалительного процесса, а снижение уровня сывороточного 1дА, особенно у женщин 1-й группы, может способствовать уменьшению преципитации и агглютинации большинства вирусов, которые попадают в организм женщины или персистируют в нем.
| Показатели | Контрольнаягруппа | 1-я группа | 2-я группа |
| Лимфоциты,Г/л | 2+1,7 | 2,5+0,2 | 2,3+0,1 |
| С03+, % Г/л | 61,2±3,7 1,22+0,04 | 72,3±2,7 * 1,81+0,17 * | 68,6±3,31,58+0,19 |
| СР4+, % Г/л | 32,5±2,20,65+0,04 | 38,9±1,1 * 0,97+0,12* | 36,2+1,6 0,83+0,11 |
| С08+, % Г/л | 33,7±2,50,67±0,09 | 26,2±2,4*0,66±0,07 | 28,5+2,20,66+0,04 |
| С016+, % Г/л | 9,6+1,3 0,19+0,05 | 15,2± 1,1 *0,38±0,06* | 13± 1,4 0,3+0,1 |
| С019+,% Г/л | 7,4±0,90,15+0,02 | 7,8±1,0 0,2+0,05 | 8±1,1 0,18+0,03 |
| С03+/ ні_а-оп+г/л | 5,57±0,08 0,11 ±0,02 | 4,37±0,15 * 0,11+0,03 | 5,26±0,13 0,12+0,05 |
| С03-/Ни\-ОР+ Г/л | 10,8+1,30,23±0,03 | 8+1,10,2±0,02 | 8,3+1,10,19±0,04 |
| С025+,% Г/л | 1,7±0,1 0,03+0,01 | 2,6±0,2 * 0,06+0,02 | 2±0,30,05+0,01 |
| СР4+/С08+ | 0,99±0,13 | 1,67±0,17 * | 1,43+0,14 * |
| Таблица 1 |
Примечание: * достоверные отличия по сравнению с контролем (Р < 0,05).
Таблица 2Функциональное состояние фагоцитирующих клеток у наблюдаемых женщин, М±т
|
| Примечание: * достоверные отличия по сравнению с контролем (р<0,05) |
4
| Показатели | Контрольнаягруппа | 1-ягруппа | 2-ягруппа |
| ЦИК, ед.опт.пл. | 61,2+4,1 | 72,4±3,5 | 69,5±3,7 |
| ідо,г/л | 7,64±0,56 | 8,81±0,57 | 8,21+0,34 |
| |дА, г/л | 2,14±0,05 | 1,25±0,04 * л | 1,88±0,05 |
| 1дМ, г/л | 1,12+0,03 | 1,75+0,04* | 1,82+0,03* |
| Таблица 3 |
Примечание: * достоверные отличия по сравнению с контролем (р<0,05); л достоверные отличия по сравнению с женщинами 2- й группы (р < 0,05).
ВЫВОДЫ
- Изучение клеточного и гуморального звеньев иммунитета у женщин с невынашиванием беременности позволило выявить значительные отклонения от контроля у женщин с невынашиванием беременности и с диагностированной энтеровирусной инфекцией отмечена более выраженная активация лейкоцитов крови, что выражалось усилением активации Т-лимфоцитов, Тхелперов, натуральных киллеров; кроме того, увеличение CD25+-клеток может приводить к стимуляции NK-клеток и макрофагов, что будет служить пусковым механизмом для цитокиновой агрессии.
- Выявленное снижение фагоцитарной активности моноцитов, нейтрофильных гранулоцитов у пациенток с невынашиванием беременности, в большей степени при диагностированной энтеровирусной инфекции, можно считать неблагоприятным условием, так как не будет способствовать эффективной противовирусной защите.
- Изменения со стороны гуморального иммунитета могут приводить, с одной стороны, к формированию патологического воспалительного процесса, с другой к снижению вируснейтрализирующей способности иммунной системы.
- Указанные расстройства со стороны клеточного и гуморального иммунитета, выявленные преимущественно у женщин с самопроизвольными выкидышами на фоне энтеровирусной инфекции, подтверждают участие иммунной системы в невынашивании, предполагают этиологическую связь энтеровирусов в возникновении этих процессов.
Все вышеуказанное является основанием для дальнейшего изучения особенностей иммунологического реагирования (системы интерферона, уровня цитокинов) у женщин с невынашиванием беременности при энтеровирусной инфекции.
ЛИТЕРАТУРА:
- Бикбулатов Р.М., Фабер Н.А., Босгажан Л.Г. Вирусоносительство у беременных женщин // Вопросы охраны материнства и детства. 1982. №
- С. 51-53.
- Володин Н.Н., Румянцева А.Г., Владимирская Е.Б., Дегтярева М.В. Цитокины и преждевременные роды // Педиатрия. 2001. № 4. С. 7277.
- Дранник Г.Н. Клиническая иммунология и аллергология. М.: ООО «Мед. информац. аг-во», 2003. 604 с.
- Ивчик Т.В. Клиническая оценка диагностического и прогностического значения функциональной активности альвеолярных макрофагов у больных хроническим бронхитом / Клиника и лечение хронического бронхита. Л., 1980. С. 40-44.
- Пальцев М.А. Цитокины и их роль в межклеточных взаимодействиях // Архив патологии. 1996. — Т. 58, № 6. С. 3-7.
- Сельков С.А. Иммунологические аспекты невынашивания беременности: Автореф. дис. … д_ра мед. наук. СПб, 1996. 42 с.5
- Сидельникова В.М. Привычная потеря беременности. М.: Триада-Х., 2000. 304 с.
- Digeon M., Caser M., Riza J. Detection of immune complexes in human sera by simplified assays with polyethylene glycol // Immunol. Method. 1977. 226. P. 497-509.
- Jonson P.M., Vince G.S. Cytokine balance and regulation in human uteroplacental tissue // The 3 congress of Europeansociety for reproductive and developmental immunology, 19-21 sept. 2000. Poznan, Poland, 2000. P. 45.
- Manchini G., Carbonare A.O., Haremans J.E. Immunochemical quantitation of antigens by single radial diffusion // Immunochemistry. 1965. № 2.- P. 235-237.
- Marz C.M., Vigano A. et al. Characterization of type 1 and type 2 cytokine production profile in physiologic and pathologic human pregnаncy // Clin. Exp. Immunol. 1996. 106. № 1. P. 127.
- Opal S.M., DePalo V.A. Anti_inflammatory cytokines // Chest. 2000. V. 117. P. 1162-1172.
- Park B., Fikring S., Smithwick B. Infection and nitrobluetetrazolium reduction by neutrophils // The Lancet. 1988. 2. P. 532-534.
- Vianna L., Khamashta M., Ordi_Ros J. Comparison of the primary and secondary antiphospholipid syndrome: A European Multicenter Study of 114 patients // Am. J. Med. 1994. 96. P. 3-9.
- Wilson W.A. Antiphospholipid syndrome // Rheumatic Disease Clinics of North America. 2001. 27. P. 3.
- Witkin S.S., Ledger W. Antibodies to chlamidia trachomatis in sera of women with recurrent spontaneous abortions // AM. J. Obstet. Gynecol. 1992. 167. P. 135.
- Zdravcovich M., Knudsen H.J., Liu X. High interferon alfa levels in placenta, maternal and cord blood suggest a protective effect against intrauterine herpes virus infection // J. Med. Viral. 1997. 51, P. 210.













Комментировать