Синдром диабетической стопы в практике врача-терапевта/ Синдром диабетической стопы как осложнение сахарного диабета. Тенденции. Классификация. Обзор литературы по проводимым исследованиям в мире.
Болгарская С.В., Ефимов А.С., ГУ «Институт эндокринологии и обмена веществ им. В.П.Комисаренко АМН Украины».
Введение
Среди всех осложнений сахарного диабета (СД), синдром диабетической стопы занимает ведущее место, поскольку в той или иной форме встречается у 30-80% больных [1, 4, 21]. Несмотря на то, что в стране предпринимаются попытки создать сеть кабинетов диабетической стопы, уровень высоких ампутаций нижних конечностей среди пациентов с СД в 2009 году возрос. Это связано с отсутствием службы «Диабетическая стопа» как таковой в Украине, а также с не выстроенным мультидисциплинарным подходом к решению проблемы (нет взаимосвязи между специалистами хирургами, эндокринологами). Кроме того, в Украине отсутствует такая специальность, как подиатрист. В основном, больные сахарным диабетом с трофическими язвами нижних конечностей попадают на прием к хирургам, которые, за редким исключением, настроены на радикальное лечение, а также отдают предпочтение вазоактивным препаратам, что зачастую бывает неоправданным.
Актуальность проблемы определяют следующие факты:
- послеоперационная смертность среди больных, перенесших ампутацию составляет 6% [14, 20];
- синдром диабетической стопы (СДС) в 20-45% случаев является причиной госпитализации в промышленно развитых странах [14];
- у больных CД риск развития гангрены нижних конечностей в 17 раз выше, чем в общей популяции [5];
- у 28% пациентов после ампутаций нижних конечностей послеоперационные раны не заживают, что влечет за собой повторную ампутацию [2, 5];
- 40–55% прооперированных больных в течение последующих 1–5 лет нуждаются в проведении контралатеральной ампутации [14];
- в течение 5 лет после проведенной ампутации 40% пациентов умирает [14].
Гнойно-некротические осложнения СДС в 85% случаев вызывают необходимость проведения ампутации нижних конечностей [5, 8]. Это достаточно распространенное осложнение СД: 4–10% в развитых странах [3,8] и более 15% в развивающихся странах [6]. На основании опубликованных ранее исследований [4, 6, 7, 9, 28], главными причинами, влияющими на развитие трофических поражений нижних конечностей у больных СД, являются диабетическая полинейропатия, ишемия тканей, возникающая вследствие поражения периферических артерий нижних конечностей, а также диабетическая остеоартропатия.
Распространенность трофических поражений нижних конечностей у больных сахарным диабетом 1 и 2 типа.
В Великобритании с начала прошлого века активно работает служба «диабетической стопы». Как результат распространенность ампутаций нижних конечностей среди больных СД в этой стране одна из наименьших в мире (7 на 100000 населения). Британские экономисты определили, что каждое предотвращение ампутации экономит 4 тысячи британских фунтов. Следует отметить, что на проблемы диабетологической службы британское правительство тратит 10% бюджетных средств. Затраты служб соцобеспечения Великобритании на одного больного СД составляют 3610 евро в год [22]. К сожалению, Украина не может даже отдаленно, приблизиться к этим показателям.
Распространенность трофических язв у больных СД 1 и 2 типа, по данным эпидемиологов различных стран, колеблется от 2,4 до 10%, что может быть связано с качеством контроля уровня глюкозы крови, наличием осложнений, возрастом обследуемых, длительностью заболевания, а также состоянием организации специальной службы «Диабетическая стопа» [21,24,28].
В нашей стране вышеуказанные статистические данные не опубликованы, хотя некоторые центры ведут мониторинг частоты ампутаций нижних конечностей (АНК). По данным эпидемиологических исследований, проведенных Институтом эндокринологии и обмена веществ АМН Украины, частота АНК у больных СД составила 8,3%, в том числе на уровне верхней трети бедра [21], а частота трофических поражений нижних конечностей составляет 18% [4]. С экономической точки зрения лечение такого осложнения, как СДС является наиболее дорогостоящим. В США на лечение трофических язв ежегодно расходуется 500 млн. долларов [14], в Англии — 13 млн. фунтов стерлингов [28], а по данным Apelqvist (1994) расходы, связанные с АНК составляют 7000 долларов на одного больного. В нашей стране точных экономических подсчетов не было проведено. Это позволяет сделать вывод о необходимости проведения профилактических мероприятий указанных осложнений сахарного диабета и соответствующих эпидемиологических и экономических исследованиях.
Классификации синдрома диабетической стопы.
Ранее считалось, что гнойнонекротические поражения стоп у больных СД являются одной из стадий диабетических ангиопатий. Так, классификация А.С. Ефимова определяет СДС как клиническое проявление диабетической макрои микроангиопатии [9] и, таким образом, учитывает только сосудистый фактор в возникновении данного осложнения:
1-я стадия (доклиническая) — сосудистые изменения регистрируются лишь с помощью инструментальных методов исследования.
2-я стадия (функциональная) — появление субъективных и физикальных клинических симптомов, обратимых под влиянием лечения.
3-я стадия (органическая) — развитие необратимых изменений в виде облитерации артерий крупного и среднего калибра и появления ишемических участков.
4-я стадия — глубокие трофические нарушения, развитие язв и гангрены.
В настоящее время общепризнано, что ведущими факторами, предрасполагающими к поражению стоп при диабете, являются периферическая нейропатия, а также нарушение гемодинамики нижних конечностей. В качестве основных форм синдрома диабетической стопы (СДС) выделены нейропатическая, нейроишемическая и ишемическая. Некоторые авторы (Гурьева И.В., 2000) [5] предлагают выделять вместо ишемической формы нейроостеоартропатическую (сустав Шарко), поскольку у больных СД и трофическими нарушениями нижних конечностей практически всегда присутствуют признаки диабетической сенсо-моторной полинейропатии, а остеоартропатия Шарко имеет ряд особенностей.
Для клинической практики важное значение имеет классификация Вагнера, дополняющая вышеописанную классификацию сведениями о голубине поражения, что очень важно для определения тактики лечения и наблюдения за динамикой язвенного процесса.
Классификация по Вагнеру
0 степень — пациенты повышенной группы риска по развитию СДС, не имеющие явных признаков поражения.
1 степень — поверхностная язва стопы.
2 степень — язва, глубина которой доходит до сухожилия и связок стопы с присоединившейся инфекцией.
3 степень — глубокое распространение инфекции с формированием абсцессов, которые нередко сопровождаются остеомиелитом.
4 степень — гангрена пальцев стопы,костей плюсны и метатарзальных костей.
5 степень — гангрена всей стопы, ведущая к АНК.
Большое разнообразие классификаций гнойно-некротических процессов в области нижних конечностей у больных СД вызывало определенные трудности при проведении исследований специалистами разных стран. Это побудило провести Международную конференцию в октябре 2001 года в Голландии, на которой клиницисты из США, Великобритании, Бельгии, Голландии и Швеции пришли к консенсусу по данному вопросу [25]: классификация должна предусматривать оценку нейропатии, гемодинамики, инфекционных осложнений и глубину и размер поражения. Специалисты, принимавшие участие в Симпозиуме провели аналогию с ТNM классификацией, используемой в онкологии и предложили использовать категории SINDS (Sepsis (инфекционное поражение), Ischemia (ишемия), Depth (глубина), Size (размер)). И все же, клиницисты оставили вопрос о завершенности предложенной классификации открытым. Таким образом, проблема единой классификации язвенных поражений нижних конечностей при СД до конца не была решена.
В 2004 году была предложена система MEASURE [24, 25], где М – измерение дефекта (длина, ширина, глубина, и площадь), Е – экссудат (количество и характеристики), А – вид раны (раневое ложе, наличие некрозов), S – выраженность болевого синдрома, R – регулярный контроль всех параметров, Е – состояние краев раны и окружающих кожных покровов. В настоящее время наиболее часто используют техасскую классификацию (Таблица 1) и классификацию PEDIS [14] (Таблица 2).
Таблица 1, Техасская классификация СДС.
| СтепеньСтадия | 0 – высокий рискязвы,ампутации | 1-поверхностноепоражение | 2-поражение свя-зок/сустава | 3-поражение кости |
| А Инфекция –Ишемия — | — | 1A | 2A | 3A |
| В Инфекция +Ишемия — | — | 1B | 2B | 3B |
| С Инфекция –Ишемия + | — | 1C | 2C | 3C |
| D Инфекция +Ишемия + | — | 1D | 2D | 3D |
Таблица 2. Классификация СДС по системе PEDIS.
| Параметр | Степень выраженности |
| Perfusion-состояние кровотока | 1 – нет признаков хронического облитерирующего заболевания ниж-них конечностей (ХОЗНАК)2 – есть признаки ХОЗНАК3 – критическая ишемия нижних конечностей (лодыжечнобрахиальный индекс < 0,5, транскутанное напряжении кислорода < 30 мм рт ст). |
| Extend-размер | Вычисление площади дефекта |
| Depth-глубина | 1 – поверхностная язва, затрагивающая кожу2 – язва, проникающая через все слои кожи с вовлечением фасций и сухожилий3 – глубокий дефект с вовлечением костей и суставов |
| Infection-инфекция | 1 – нет симптомов и признаков инфекции2инфекционное воспаление кожи и жировой клетчатки без системных признаков; наличие минимум 2 признаков (местный отек, уплотнение, гиперемия более 2 см, отделяемое)3гиперемия более 2 см, признаки абсцесса, остеомиелита, гнойногоартрита, системные признаки отсутствуют 4 – наличие системных признаков инфекции: температура тела бо- лее 38°С, ЧСС > 90 в мин, лейкоцитоз > 12000 |
| Sensation-чувствительность | 1 – чувствительность стоп сохранена2 – потеря тактильной (10 г монофиламент) и вибрационной (128 ГЦ камертон, биотензиометрия > 25 V) чувствительности |
Роль диабетической нейропатии в развитии синдрома диабетической стопы.
В большинстве случаев причиной СДС, включая гангрену, является периферическая сенсорная, моторная и вегетативная нейропатия [1,6]. Хроническая сенсомоторная нейропатия — наиболее часто встречающееся осложнение. Сенсорная нейропатия характеризуется снижением болевой, температурной, вибрационной чувствительности, и образование язв зачастую связано именно со снижением порога болевой чувствительности [2, 6, 24] Потеря болевой чувствительности приводит к тому, что пациент перестает адекватно реагировать на травматические воздействия: может встать, например, на острый предмет и не ощутить этого, приложить к ногам горячую грелку и получить ожог [5, 8]. Иногда образование язв происходит вследствие острой травмы, но чаще всего из-за длительного травматического влияния плохо подходящей обуви или небольшой травмы инородным предметом, находящимся в обуви [9, 14]. По статистике причиной развития трофических язв на стопах у больных СД в 85% случаев является травма [4].
Моторная нейропатия приводит к изменению иннервации различных мышечных групп, что зачастую ведет к дисбалансу между мышцамисгибателями и разгибателями стопы, атрофии мелких мышц стопы с развитием таких деформаций, как «когтевидные» и молоткообразные пальцы, выступающие головки метатарзальных костей. Это приводит к формированию зон повышенного плантарного давления на стопу как во время статической (стояние), так и динамической (ходьба) нагрузки на стопу [2, 7, 14, 28].
В свою очередь, зоны повышенного давления в сочетании с сухостью кожных покровов (следствие атрофии потовых желез из-за вегетативной нейропатии) приводят к возникновению мозолей (гиперкератозов), которые оказывают дополнительное травматическое воздействие на мягкие ткани стопы [2, 5, 6, 23]. Постоянное давление на эти участки приводит к воспалительному аутолизу подлежащих мягких тканей, формированию язвенного дефекта. Исследования, проведенные в Великобритании [22, 23], доказывают, что простое удаление гиперкератозов у больных уменьшает показатели плантарного давления в этих локусах и приводит к снижению риска возникновения язв в этих участках на 26%.
Вегетативная нейропатия вызывает снижение или полное отсутствие функции потоотделения, нарушение иннервации артерио-венозных шунтов и усиление перфузии по поверхностным сосудам нижней конечности [1, 2, 7]. Сухая кожа стопы характеризуется сниженными барьерными свойствами, а возникающие при этом трещины являются входными воротами для микроорганизмов, обитающих на ее поверхности, что может вызывать развитие инфекционного воспаления мягких тканей. С целью профилактики указанных трофических нарушений рекомендовано применять Бальзамед базаль и Бальзамед интенсив – мази, в состав которых входят увлажняющие компоненты, молочная кислота и мочевина, разрыхляющие участки гиперкератозов, а также растительные масла (жожоба, алое) и витамины (А,Е, В5).
Одним из последствий вегетативной нейропатии является «аутосимпатэктомия» (открытие артерио-венозных шунтов) и обызвествление медии артерий или, так называемый, склероз Менкеберга, определяемый рентгенологически и, нередко, ошибочно расцениваемый как облитерирующий атеросклероз. Склероз Менкеберга не связан с атеросклерозом и не влияет на его развитие, но в сочетании с «аутосимпатэктомией» может способствовать сбросу крови через шунты из-за невозможности вазоконстрикции, что, в свою очередь, приводит к снижению кровотока в тканях [10, 20]. Таким образом, происходит сбрасывание обогащенной кислородом крови через артериоловенулярные шунты из артериол в венулы с характерным для этого синдромом обкрадывания и последующе гипоксией тканей стопы. Для медиокальциноза артерий характерно поражение артерий мышечного типа, в отличие от атеросклероза, для которого характерно поражение артерий эластичного типа [8]. При гистологических исследованиях срезов сосудов больных склерозом Менкеберга выявляется накопление кальция вокруг миоцитов [6]. Вначале кальций откладывается в гранулах клеток, где накапливается и превращается в гомогенизированный базофильный детрит, который имеет тенденцию к формированию кольцевидных структур.
При этом рентгенографически можно выявить узелковые образования, за счет которых сосуды приобретают вид «гусиной трахеи». При более распространенном процессе сосуды превращаются в «кальциевую трубку». Незначительный медиокальциноз не оказывает повреждающего воздействия на стенки сосудов. Однако в комбинации с атеросклерозом он может вызвать ухудшение кровообращения в области нижних конечностей. Таким образом, сочетание диабетической нейропатии с поражением сосудов нижних конечностей увеличивает риск возникновения трофических язв стоп у больных СД. Нами было обследовано 22 пациента со 2 типом СД средний возраст и длительность СД которых составил соответственно 60,3±2,1 и 13,5±1,4 лет и степеню диабетической нейропатии по шкале NDS (Young., 1996) в балах в среднем 9,25±0,16 а также ЛБИ в среднем 1,1±0,1, что свидетельствовало об отсутствии нарушений магистрального кровотока в области нижних конечностей. По результатам транскутанной оксиметрии величина величина напряжения кислорода в тканях правой и левой стопы составила соответственно 46,9±3,0 та 48,5±2,5 мм рт. ст. Таким образом, парциальное напряжение в тканях стопы было достоверно снижено (P<0,01), по сравнению с нормой (60мм рт. ст.). Следовательно, диабетическая нейропатия и микроангиопатия нижних конечностей взаимосвязаны и логично предположить, что назначение вазодилятаторов при наличии артериоло-венулярного шунтирования, обусловленного аутосимпатектомией может усугубить феномен «обкрадывания».
По данным M.E. Edmonds с соавторами [25], среди 239 пациентов с СД и язвами нижних конечностей в 62% случаев отмечались признаки выраженной диабетической нейропатии, у 13% больных язвы ассоциировались с чисто ишемическими поражениями и у 25% пациентов носили смешанный характер. Кроме того, было установлено, что у больных с нарушением различных видов чувствительности на протяжении 2,5 лет после постановки диагноза “диабетическая нейропатия” развивались трофические поражения нижних конечностей [28].
P.R. Cavanagh с соавторами в 87% случаев регистрировал признаки диабетической нейропатии у больных СД с трофическими язвами стоп [28].
По данным клиники Института эндокринологии и обмена веществ им. В.П. Комисаренко АМН Украины, при обследовании в кабинете диабетической стопы более 2 тысяч больных СД, наиболее часто встречались клинические проявления периферической сенсомоторной полинейропатии (56%) и только у 7% обследованных были зарегистрированы признаки критической ишемии нижних конечностей [4].
Травматическое воздействие на ткани вызывает стимуляцию ноцицептивных С волокон и приводит к вазодилятации и усилению кровотока в локусе травмы [8]. При диабетической нейропатии нейрогенная вазодилятация ослаблена и это неблагоприятно сказывается на течении раневого процесса. У здорового человека в положении стоя происходит вазоконстрикция сосудов стопы, так называемая постуральная вазоконстрикция, возникающая вследствие аксон-рефлекса [2]. У больных СД при нейропатии нарушение данного процесса приводит к повышению капиллярного давления и гиперперфузии, которая вызывает гиперфильтрацию жидкости из микроциркуляторного русла с последующим отеком стопы [2, 8]. Плохо подобранная обувь в сочетании с отеком в области стопы может вызвать травму или усугубить ишемию тканей [14].
Таким образом, диабетическая полинейропатия представляет собой серьезное осложнение СД и играет ведущую роль в развитии язвенных поражений стоп у данной категории больных.
Роль диабетической ангиопатии нижних конечностей в развитии синдрома диабетической стопы.
Облитерирующий атеросклероз артерий анатомически характеризуется неравномерным уменьшением внутреннего их просвета. За относительно длительный промежуток времени сужение сосуда достигает критической величины, что влечет за собой закрытие внутреннего просвета артерии, ее окклюзию атеросклеротической бляшкой [8]. Поскольку окклюзия развивается постепенно, в артериях создаются условия для развития коллатерального кровообращения, компенсирующего нарушенный магистральный кровоток [28]. Важно, что за этот промежуток времени происходит компенсаторная перестройка уровня обменных процессов в тканях, в результате которой уменьшается потребление кислорода [28]. У больных СД и облитерирующим атеросклерозом периферических артерий степень выраженности ишемии тканей нижних конечностей зависит не столько от окклюзии сосуда, сколько от степени развития коллатерального кровообращения [12, 16].
Гангрены и акральные некрозы у данной категории больных СД возникают чаще, чем у больных с атеросклерозом, но без диабета [20]. Хотя патоморфологический анализ бляшек у больных СД и без него не выявляет никаких различий [8], атеросклеротическое поражение сосудов нижних конечностей у больных СД имеет некоторые особенности. Так, оно возникает в молодом возрасте [6], имеет «продольный» характер облитерации и чаще поражает сосуды голеней [6, 28]. По данным Фрамингамского исследования (США) [1], которое проводилось на протяжении 16 лет, у больных СД на 50% чаще регистрируется отсутствие пульсации в области периферических сосудов стопы, при этом данное поражение встречается с одинаковой частотой как у мужчин, так и у женщин в идентичных возрастных групп.
Диабетическая ангиопатия, с морфологической точки зрения, делится на макроангиопатию (артерии и артериолы) и микроангиопатию (капилляры) [10]. В настоящее время существует две точки зрения на патогенез данного осложнения СД: метаболическая и генетическая [2]. Последняя подтверждается тем, что в биоптатах икроножных мышц у лиц с предиабетом было обнаружено утолщение базальной мембраны капилляров, что является одним из патоморофологических признаков диабетической микроангиопатии [10]. Существует мнение, что данная теория реализуется через метаболические нарушения, характерные для СД [8]. Дефицит инсулина и гипергликемия усиливают образование гликопротеинов и накопление их в базальной мембране сосудов. Активируется гликозилирование белков и внутрисосудистых факторов, что изменяет их свойства и повышает иммуногенность [8, 9].
Кроме того, отмечаются изменения эндотелия капилляров: отек эндотелиоцитов, увеличение количества цитоплазматических выростов эндотелия и микроворсин, вдающихся в просвет капилляра и препятствующих кровотоку [1]. С развитием диабетических ангиопатий отмечается повышение уровня b-тромбоглобулина, фибриногена, тромбоцитарного фактора IV, которые стимулируют агрегацию тромбоцитов [1].
Названные выше патологические изменения вызывают нарушения микроциркуляции с последующей ишемией тканей.
Метаболическая теория предполагает, что основной причиной развития ангиопатий является хроническая гипергликемия и связанные с ней нарушения. В подтверждение данной теории можно привести исследование DCCT и UKPDS [28], по результатам которого были сделаны выводы о том, что хороший метаболический контроль и интенсивная инсулинотерапия могут привести к регрессу или стабилизации микроциркуляторных нарушений.
Роль диабетических микрои макроангиопатий в развитии СДС является предметом многолетних дискуссий. Наиболее распространенной была точка зрения о развитии атеросклеротического процесса в артериях среднего и мелкого калибров [9]. Считалось, что причиной некроза кожи у больных сахарным диабетом являются изменения в микроциркуляторном русле, хотя именно проведение реконструктивных сосудистых операций приводило к восстановлению адекватного кровотока в артериолах [8]. Lо Gefo и Coffman [2] в 1984 году опровергли точку зрения, что у больных CД прежде всего имеются облитерирующие поражения артериол, приводящие к ишемическому некрозу тканей. Они аргументировали свои выводы отсутствием специфических патоморфологических признаков атеросклеротического поражения у лиц с СД при сравнении с патологоанатомическим материалом, который получили от больных, имеющих облитерирующий атеросклероз артерий нижних конечностей без диабета. Вместе с тем, у больных СД выявлено утолщение базальной мембраны капилляров мышечной ткани. Данные капилляроскопии свидетельствуют, что у больных диабетом имеются значительные морфологические изменения (извилистость капилляров, их дилатация [10, 33]. При СД также имеет место ряд функциональных расстройств микроциркуляторного русла. Эти изменения включают повышение проницаемости и нарушение реактивности сосудистой стенки. Необходимо подчеркнуть, что они являются обратимыми в ранние сроки от момента развития и необратимыми при длительном его течении [8].
Нарушение кровообращения в vasa nervorum ведет к снижению парциального давления в нервной ткани, что вызывает снижение скорости проведения импульса по нервному волокну, усугубляя развитие нейропатии [5].
Таким образом, нарушения со стороны микроциркуляторного русла (ограничение вазодилятации, нарушение постуральной вазоконстрикции, а также открытие артерио-венозных шунтов) приводят к патологическому перераспределению кровообращения: кровь, минуя капиллярное русло, через артерио-венозные шунты течет из артериол в венулы. Ограничение вазодилятации ведет к уменьшению кровоснабжения травмированных тканей и, таким образом, к нарушению процесса хемотаксиса, бактерицидной активности нейтрофилов и плохой пенетрации антибиотиков к некротизированным тканям [1, 8]. Данные изменения ведут к быстрому распространению инфекционного процесса и расширению зон некроза [17].
Инфекционные поражения при синдроме диабетической стопы.
Реакция организма на воспалительный процесс — один из основных факторов, обеспечивающих эффективную репарацию пораженных тканей. Еще в 1984 году Gibbons и Eliopoulos [8] отмечали, что почти все высокие ампутации у больных СД проводятся вследствие неадекватного лечения воспалительного процесса. В «доантибиотиковую» эру главной причиной смертности этой категории больных было быстрое распространение инфекционного процесса, поэтому основным методом лечения были ампутации на уровне верхней трети бедра [1, 8]. На сегодняшний день в арсенале клиницистов существует много антибактериальных препаратов, с помощью которых можно избежать вышеупомянутых осложнений.
До сих пор открытым остается вопрос о том, являются ли инфекционные поражения нижних конечностей у больных СД следствием пониженной резистентности к инфекционным возбудителям или следствием неадекватного кровоснабжения, в результате которого воспалительный процесс быстро распространяется и приводит к образованию некроза [17]. Некротизированные ткани — благоприятная среда для анаэробных микроорганизмов, особенно, когда в ране присутствуют представители аэробной флоры [8, 17]. По данным I. Farris [28], у больных с трофическими язвами нижних конечностей в 80% случаев высевается смешанная анаэробно-аэробная флора: Staph.aureus, Proteus mirabilis, Proteus vulgaris, Pseudomonas aerugenosa. Реже высеваются E. Coli, Klebsiela pneumonia, Streptococcus, Clostridium perfrigens, Bacteroides. Патогенные микроорганизмы продуцируют гиалуронидазу, в результате активации которой возникает некроз тканей с охватом подкожно-жировой клетчатки, мышечной ткани, костно-связочного аппарата. В тяжелых случаях происходит тромбоз мелких сосудов и как следствие вовлечение в некротический процесс новых обширных участков мягких тканей. Следует отметить, что нередко выделенные штаммы являются резистентными к традиционным антибактериальным препаратам. Поэтому важно проведение бактериологических исследований с целью выявления патогенных штаммов микроорганизмов и их чувствительности к антибиотикам [2, 3].
Инфицированные раны при СД имеют более тяжелое течение и неблагоприятный прогноз в связи с нарушением воспалительного ответа на инфекцию, по сравнению с больными с трофическими поражениями без СД [2, 4]. У больных с декомпенсированным СД и хроническими очагами воспаления выявлено нарушение процесса миграции лейкоцитов и процесса фагоцитоза вследствие снижения адгезивной функции гранулоцитов, нарушения хемотаксиса и диапедеза [8]. Это неблагоприятно сказывается на процессе репарации и ухудшает течение раневого процесса. Таким образом, борьба с инфекцией и возникшим воспалительным процессом — один из основных факторов успешного лечения трофических поражений при СД.
Инфицирование трофических поражений стоп при СД приводит к развитию остеомиелита. Диагностика данного осложнения затруднена. Точный диагноз остеомиелита можно поставить, используя комплексное обследование пациентов, которое включает биопсию кости, компьютерную томографию и рентгенологическое исследование. Ряд исследователей [6, 8, 28] считают, что обнаружение кости при исследовании трофического дефекта стопы с помощью зонда у больных СД позволяет ставить диагноз остеомиелита, не прибегая к вышеперечисленным методам.
Инфицирование костной ткани при хроническом остеомиелите имеет свои особенности. Бактерии, размножаясь в костной ткани, образуют микроколонии, которые покрыты гликокаликсом, состоящим из продуктов жизнедеятельности последних [17]. Это обеспечивает устойчивость микроорганизмов к антибактериальным средствам.
Таким образом, предотвращение АНК у больных СД с трофическими поражениями нижних конечностей зависит от предотвращения распространения инфицирования мягких тканей стопы.
Другие патогенетические факторы, влияющие на развитие синдрома диабетической стопы.
Многолетние исследования доказывают, что при наличии хронических осложнений СД, в частности диабетической ретинопатии и нефропатии, трофические поражения нижних конечностей возникают чаще [6, 7, 8, 28]. Курение и употребление алкоголя также влияет на развитие ишемических язв нижних конечностей [25, 28]. Имеются данные о том, что язвенные поражения часто (каждые 12 месяцев) рецидивируют [24]. Неправильный уход за ногами, предшествующие язвы или ампутации нижних конечностей — основные предрасполагающие факторы очередной трофической язвы.
Отмечается взаимосвязь возникновения трофических язв стоп с повышенным уровнем гликозилированного гемоглобина у больных СД [6, 8]. Длительная декомпенсация СД, безусловно, ухудшает течение заболевания, способствует развитию хронических осложнений (микро и макроангиопатий и нейропатии), которые являются патогенетическими факторами СДС.
Имеет значение уровень обучения больных и социальные условия жизни. Многими исследованиями [28] показано, что больные с плохим пониманием своего заболевания, правил ухода за ногами также имеют более высокий риск развития трофических язв нижних конечностей. Только 25% больных, у которых развились язвы стоп, знали, что они относились к высокой группе риска по данному осложнению; в то время как 75% больных не было информировано о факторах риска и необходимых действиях по предупреждению язв [28].
Другими исследованиями было показано, что АНК в связи трофическими язвами проводятся в 3 раза чаще у лиц, не прошедших обучение [28].
Одинокие пациенты несвоевременно обращаются за медицинской помощью, и период их реабилитации протекает достаточно сложно [6].
Дифференциальная диагностика различных форм синдрома диабетической стопы.
Lawrence [6] подробно описал различные проявления трофических поражений нижних конечностей у больных СД.
Каждый тип язв имеет характерные особенности. Так, нейропатические язвы чаще локализуются в области проекции головок метатарзальных костей, апикальной поверхности пальцев стоп, дорзальной поверхности проекции межфаланговых суставов и в области пяточной кости [4, 5, 6, 8, 28]. Эти язвы безболезненны при хирургической обработке, имеют длительный (месяцы, годы) анамнез, они глубокие, с участками гиперкератоза по краям, при этом воспалительный процесс ограничен и на дне язвы отмечаются относительно здоровые грануляции (типа «малинового желе») [28] .
В отличие от нейропатических, ишемические язвы очень болезненны при обработке, имеют неровные края без участков гиперкератоза и характеризуются наличием сухих некрозов [6, 28].
Нейроишемическая язва по клиническим проявлениям похожа на ишемическую и отличается от нее лишь тем, что она менее болезненна при обработке, имеет длительный анамнез и, как правило, локализуется на маргинальных участках стопы (латеральная и медиальная лодыжки, латеральный край 1-го и 5-го плюснефаланговых сочленений) [3, 4, 6].
Для успешного лечения СДС необходим дифференцированный подход к терапии язвенных дефектов стоп у больных СД, для чего клиницисты проводят целый ряд исследований.
К непосредственной оценке трофического поражения относятся: визуальная оценка состояния стоп, определение глубины язвы, наличия и степени распространенности воспалительного процесса, проведение бактериологического исследования.
Определение состояния периферической иннервации
Учитывая тот факт, что диабетическая нейропатия является одним из патогенетических факторов развития трофических поражений нижних конечностей у больных СД, необходимо в первую очередь оценивается состояние периферической иннервации.
Клиническая оценка периферической иннервации включает, прежде всего, осмотр, и проведение необходимых диагностических тестов.
По наблюдениям различных исследователей [5, 6, 20] для вегетативной нейропатии характерна гиперемированная, теплая стопа с нарушенным потоотделением (в начальных стадиях повышенным, в последующих сниженным — сухость кожи, трещины), отечность голеней и стоп. Признаки моторной нейропатии — характерные деформации стоп (по типу «когтистой» лапы, «молоткообразные пальцы и т.д.).
Признаки ишемии — сухая блестящая кожа бледной или цианотичной окраски, выпадение волос, утолщение ногтей, часто с их грибковым поражением, атрофия подкожно-жировой клетчатки.
Ранее для оценки состояния стоп у больных СД неврологические исследования широко не применялись. В последнее время для диагностики нарушений периферической иннервации проводили ряд диагностических тестов.
Наиболее широко применяемой методикой было определение порога вибрационной чувствительности с помощью градуированного камертона или биотезиометра [6, 28].
Некоторые клиницисты отмечали удобство использования набора монофиламентов СеммесВайнштейна, с помощью которых определяли степень нарушения восприятия кожей давления с силой в 1, 10 и 75 г/см2. По информативности и чувствительности данный тест не только не уступал, но и превосходил биотезиометрию [6].
Важным моментом в оценке состояния периферических нервов являлось определение болевой и температурной чувствительности, а также оценка рефлексов [2, 8].
Наиболее чувствительным и информативным методом диагностики нарушений иннервации нижних конечностей была признана электромиография, позволяющая выявить самые ранние проявления полинейропатии. Так, снижение скорости проведения импульса по нервному волокну отмечалось у 12–25% лиц, страдающих сахарным диабетом от 1 до 3 лет [8]. Однако, несмотря на высокую информативность, электромиография пока не нашла широкого применения в практике, что связано с ее трудоемкостью и высокой стоимостью.
В настоящее время для комплексной оценки степени сенсомоторной нейропатии разработано несколько шкал. Наиболее широко используют Neuropathy Symptomatic Score и Neuropathy Disability Score, которые предложены группой Neurodiab при Европейской ассоциации изучения сахарного диабета. Первая шкала предполагала оценку болевого синдрома, характерного для диабетической сенсомоторной нейропатии по баллам (максимальное число баллов — 9). Вторая шкала предусматривала определение степени нарушения болевой, температурной и вибрационной видов чувствительности с максимальной оценкой в 10 баллов [2, 6, 27]. Таким образом, показатели неврологических тестов широко используются для определения групп повышенного риска данного осложнения СД. Некоторые авторы (Marriman L., 1996; Дедов И.И. 1998) указывают на возможность использования оценки неврологического статуса для дифференциальной диагностики различных видов трофических поражений нижних конечностей. Так, например, Дедов И.И. (1998) представляет данные об отлиичиях в показателях вибрационной чувствительности у пациентов с нейропатическими и нейроишемическими язвами стоп. Следовательно, оценка показателей неврологических тестов может быть использована для дифференциальной диагностики различных видов трофических поражений стоп у больных СД. Проведенные нами исследования установили, что у пациентов с нейропатическими и нейроишемическими трофическими язвами нижних конечностей показатели неврологических тестов (виброметрии, тактильной, дискриминационной, болевой и температурной чувствительности, а также состояние сухожильных рефлексов) не отличались [4]. Так, например, показатели виброметрии у пациентов с нейропатическими и нейроишемическими язвами составляли соответственно 1,9±0,3 и 1,9±0,4 усл. ед. (p>0,05), а оценка степени тяжести диабетической полинейропатии по шкале M. Young составила соответственно 7,1±0,5 и 6,8±0,6 баллов (p>0,05) [1].
По данным L. Vileikyte (1997) почти у 50% больных с трофическими поражениями нижних конечностей после заживления последних на протяжении последующих 12 месяцев возникают рецидивы. Это может быть связано с прогрессирующим нарушением иннервации нижних конечностей, на фоне которого происходит формирование язвенных поражений. По данным различных исследователей [4], у больных сахарным диабетом как 1 так и 2 типа с рецидивирующими язвами нижних конечностей отмечается более выраженное поражение вибрационной, температурной и тактильной видов чувствительности по сравнению с группой пациентов, у которых указанное осложнение (СДС) зарегистрировано впервые.
Клиническое исследование состояния периферического кровообращения в области нижних конечностей включает осмотр, пальпацию артерий и проведение инструментального исследования. Осмотр проводят вначале в вертикальном, а затем в горизонтальном положении больного. При этом отмечают цвет кожи, состояние волосяного покрова, ногтевых пластинок, наличие или отсутствие отека тканей и т.д.
Для оценки состояния периферического кровотока в голенях и стопах используют различные инструментальные методы. Наиболее распространенной и доступной является методика реовазографии, которая позволяет выявить поражения сосудов функционального и органического характера. Тем не менее, данный метод является малоинформативным и устаревшим. По данным И.И. Дедова и соавторов [8], у больных как с нейропатической, так и со смешанной формой СДС регистрируется спастикоатонический тип реовазограмм, что не позволяет диагностировать начальные стадии окклюзии артерий стоп. Использование нитроглицеринового теста на фоне пареза капилляров, вызванного вегетативной нейропатией, не позволяет правильно оценить проходимость магистральных артерий конечностей [9, 10].
В течение ряда лет для оценки кровоснабжения конечностей довольно широко применяли метод термографии [10], основанный на том, что расстройство кровообращения характеризуется изменением температуры кожи конечностей, а, следовательно, изменением инфракрасного излучения, степень которого можно зарегистрировать с помощью тепловизора. Для больных с нейропатической и смешанной формами СДС характерен «ампутационный» тип термограмм, что связано со снижением температуры дистальных отделов конечностей на фоне нейропатии [9, 10].
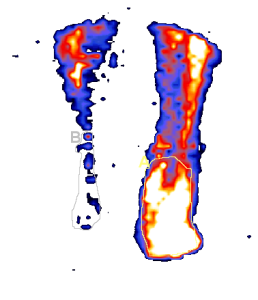
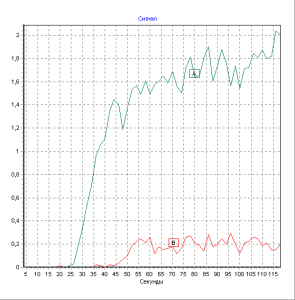
В последнее время ведущее место в ранней диагностике и последующем динамическом наблюдении за состоянием периферического кровотока у больных с СДС занимает метод ультразвуковой допплерометрии, который заключается в определении величины лодыжечно-брахиального индекса с помощью тонометра и аппарата допплер. Индекс рассчитывается как соотношение между систолическим давлением в плечевой артерии и артерии тыла стопы. В норме этот показатель равен 1. Для облитерирующих заболеваний артерий характерно снижение индекса менее 1. Уменьшение лодыжечнобрахиального индекса до 0,5 расценивается как критическая ишемия, требующая вмешательства сосудистого хирурга [4-6, 20]. В литературе нет четких указаний на то, какие значения ЛБИ позволяют поставить диагноз нейропатического или нейроишемического язвенного дефекта. Следует отметить, что 5–10% больных СД страдают кальцинозом интимы артерий эластичного типа, что при проведении ультразвуковой допплерометрии дает ложно завышенные величины ЛБИ. В связи с этим была разработана проба с нагрузкой (ишемическая проба), с помощью которой удается определить степень нарушения кровотока по магистральным артериям гнижних конечностей. Тем не менее, ультразвуковая допплерометрия не позволяет оценить состояние микроциркуляторного русла. Радионуклидная ангиография является методом, который позволяет проанализировать состояние гемодинамики на различных уровнях. Основными показателями данного метода являются время полного кровотока (ВПК), отражающий артериальный кровоток в конечности в целом, время быстрого кровотока (ВБК) – отражает состояние артериального кровотока по сосудам крупного калибра, время медленного кровотока (ВМК) – показатель кровообращения в сосудах среднего и малого калибра и венозный отток (ВО) – отражает состояние оттока по венам (рис. 1).
Рис. 1. Показтели радионуклидной ангиографии у больного СД 2 типа с нейроишемической язвой правой стопы.
Пациент: Г. Дата рождения: 1951. Дата исследования: 24-10-01.
Номер исследования: НК87
Изотоп:TcДоза:600 МБк
Увеличение ВМК до 17,4±1,7 секунд и ВПК до 28,0±2,2 секунд характерно для нейроишемических язвенных поражений нижних конечностей [4].
Для оценки состояния микроциркуляторного русла используют лазерную флоуметрию, позволяющую определить интенсивность движения крови по системе капилляров вне зависимости от их тонуса [8]. Наиболее информативным методом, позволяющим оценить жизнеспособность тканей, является определение транскутанного напряжения кислорода (ТсрО2) [2, 16]. Считается, что при значении ТсрО2<30 мм Hg риск развития трофических поражений нижних конечностей высок, а при значении 20мм Hg заживление раны маловероятно [2].
Наиболее достоверным методом диагностики артериальной окклюзии является ангиография [8, 16]. Ангиографию у больных СД производят по методике S. Seldinger [16], что позволяет наиболее информативно судить о характере магистрального и коллатерального кровотока при облитерирующем атеросклерозе у больных СД.
Еще в 1984 году был внедрен новый метод исследования сосудов — цифровая субтракционная ангиография, основанная на усилении контрастирования сосудов и вычитании фона реального изображения с помощью компьютерной обработки.
В последнее время с целью исследования гемодинамики в области нижних конечностей используют дуплекс-ультразвуковую диагностику, которая объединяет принцип работы допплера и ультразвукового обследования, что позволяет получить информацию о состоянии кровообращения в нижних конечностях и выявить место окклюзии [2, 3, 7, 20]. Данный метод имеет преимущества по сравнению с ангиографией, так как является неинвазивным и безопасным в плане развития осложнений (острая почечная недостаточность и аллергическая реакция на введение рентгенконтрастного вещества) [16].
В последнее время в клинической практике используются радионуклидные методы диагностики состояния гемодинамики в области нижних конечностей, не нашедшие до сих пор применения в диабетологии.
Известны работы, посвященные радионуклидной диагностике проницаемости сосудов, магистрального, мышечного и тканевого кровотока с помощью 133-ксенона, альбумина и йодида натрия (131-I) у больных с облитерирующим атеросклерозом сосудов нижних конечностей [8], диабетическими ангиопатиями [16], позволяющими определить наличие очагов воспаления.
Определение состояния костных структур
Наиболее распространенным методом оценки состояния костных структур является рентгенографическое исследование. Характерные рентгенологические признаки остеомиелита: остеопороз, деструкция, остеолиз кости, секвестрация, деформация и дезинтеграция суставов [2, 8]. Однако oтсутствие рентгенологических признаков остеомиелита еще не исключает данный диагноз. Некоторые исследователи считают, что если при обследовании дна язвы с помощью зонда можно пропальпировать костные структуры, то можно ставить диагноз остеомиелита [28].
Рентгенологическое исследование позволяет выявить изменения на выраженных стадиях. С целью диагностики состояния костных структур в клинической практике использовали сканирование Тс99 m . При развитии остеоарторопатии уже на ранних стадиях отмечалось повышенное поглощение Тс99 m в связи с увеличенным кровотоком. Такое сканирование является очень чувствительным методом, однако неспецифичным, так как повышенное накопление препарата фиксируется также при инфицировании и других воспалительных процессах. Наиболее чувствительными были методы магнитного резонанса и компьютерной томографии, которые позволяли четко выявить деструкцию костей.
Кроме вышеперечисленных методик одним из наиболее информативных методов, позволяющих определить состояние костных структур, является денситометрия, с помощью которой можно установить наличие остеопороза, остеоартропатии Шарко.
Современные подходы к лечению синдрома диабетической стопы.
Успех лечения трофических поражений нижних конечностей при СД зависит от следующих факторов: контроля воспалительного процесса, разгрузки пораженной конечности, а также от степени нарушения гемодинамики последней и адекватного местного лечения [3, 4, 6, 23, 28], .
До недавнего времени считалось, что основной причиной возникновения трофических поражений нижних конечностей являются диабетические ангиопатии. Данная точка зрения ложилась в основу консервативной терапии этого вида осложнения сахарного диабета. И по сей день пациентам с нейропатическими видами трофических расстройств нижних конечностей назначают реополиглюкин, трентал и другие медикаментозные средства, направленные на коррекцию гемореологических расстройств у больных сахарным диабетом [16]. Тем не менее, у пациентов с нейропатическими язвами применение вышеуказанных препаратов нецелесообразно в связи с аутосимпатектомией. Также в литературе сообщается о необходимости применения гепарина, в то время как назначение данного препарата должно быть строго дифференцированным. В настоящее время на смену гепарину приходят тиенопиридины (тиклопидин), гликозаминогликаны («гепариноиды» — сулодексид) [2, 18, 20]. Проведенное в Италии в 2001 году пилотное исследование (Koblik et. al.) продемонстрировало, что в группе пациентов, принимавших сулодексид заживление язвенного дефекта проходило более интенсивно, по сравнению с группой традиционной терапии [28]. Хорошо зарекомендовал себя депротеинизированный гемодериват крови телят, антигипоксант и антиоксидант Актовегин в дозе 2000 мг в/в капельно на протяжении 20 дней с последующим приемом препарата в таблетированном виде на протяжении 140 дней. По некоторым данным применение актовегина в комплексной терапии смешанных трофических поражений нижних конечностей при СД увеличивало показатели транскутанной оксиметрии [26]. Кроме того, по данным последнего многоцетрового рандомизированного исследования Актовегин может быть рекомендован в качестве препарата патогенетической терапии диабетической полинейропатии.
Имеются данные об успешном применении в комплексном лечении трофических поражений нижних конечностей адекватных доз лучевой терапии [20], магнито-лазерной терапии [10] и плазмоэритросорбции [9], микроволновой резонансной терапии. Многообещающие результаты продемонстрировало исследование, проведенное в 2000 году Heing et.al. по сравнительному анализу эффективности гипербарической оксигенации с давлением от 1.004 до 1.013 атм. по сравнению с традиционным лечением больных сахарным диабетом и трофическими язвами нижних конечностей. В основной группе эффективность лечения составила 90% за 2-16 недель по сравнению с группой контроля, где указанные показатели составили 22% за 7 месяцев [28].
Вследствие утраты болевой чувствительности пациенты не сразу могут заметить, что у них на стопе образовалась язва. Поэтому повреждение инфицируется и на момент обращения к врачу часто представляет собой глубокий дефект с распространенным воспалительным процессом (флегмона, остеомиелит) [17, 20]. Наличие инфекционного процесса, а также его распространение являются угрожающим состоянием и причиной АНК в 25–50% случаев [6].
Рекомендуется назначать антибиотики с учетом бактериологических исследований; в случае недоступности этого метода оправдано эмпирическое применение антибиотиков широкого спектра действия (бета-лактамы, хинолоны, цефалоспорины второго поколения), при наличии анаэробной инфекции — метронидазола и клиндамицина [6, 17]. Известно, что при диабете возбудители инфекционного процесса представляют собой полимикробную флору [6, 8, 17, 20, 28]. Возбудителями поверхностных поражений чаще являются грамположительные кокки (золотистый стафилококк или эпидермальный стрептококк). При глубоких поражениях и наличии ишемии наряду с грамположительными кокками высеваются анаэробы и грамотритцательные бактерии [17]. Адекватная и своевременная антибиотикотерапия обеспечивает успех лечения. Клинический эффект проводимой терапии оценивают через 3–4 дня. В последнее время преимущество отдают антибиотикам, которые имеют высокую биодоступность (офлоксацин, ципрофлоксацин), так как при диабете нарушается проницаемость сосудистой стенки [6, 8, 17, 20, 22].
Немаловажно лечение диабетической нейропатии. С целью купирования болевого синдрома назначают антидепрессанты, антиконвульсанты [2]. Опубликованы результаты, свидетельствующие об эффективности местного применения препарата капсаицин (экстракт красного перца) для уменьшения болевого синдрома у больных с диабетической нейропатией (Capsaicin Study Group, 1992). Однако побочные эффекты (эритема, дерматиты) ограничивают применение капсаицина. Все вышеперечисленные препараты являются средствами симтоматического лечения, а не патогенетического лечения. Широкое применение нашли препараты a-липоевой кислоты, особенно ее меглюминовая соль, как наиболее безопасная, (тиогамма, диалипон), механизм действия которых заключается в уменьшении оксидативного стресса, увеличении эндогенного антиоксидантного потенциала, уменьшении перикисного окисления в периферических нервах, улучшении эндоневрального кровотока, что приводит к увеличению скорости нервного проведения [2, 6]. aлипоевая кислота действует как коэнзим, способствующий превращению пирувата в ацетил СоА и, таким образом, ингибирует глюконеогенез, активирует митохондриальные ферменты, которые участвуют в метаболизме глюкозы, снижает кетогенез [26]. Антиоксидантное действие препаратовa-липоевой кислоты реализуется путем прямой инактивации свободных радикалов, а также путем восстановления эндогенных радикалов антиоксидантной системы (витамин Е, витамин С, глютатион, липоевая кислота и т.д.) [26]. Известно, что оксидативный стресс является одним из патогенетических факторов диабетической нейропатии [26]. Продукция свободных радикалов возрастает в условиях неэнзиматического гликозилирования белков. Вероятно, конечные продукты неэнзиматического гликозилирования (AGE) и нарушение эндоневральной перфузии связаны между собой [26]. Гликозилирование белков эндотелиального матрикса приводит к изменению кровотока в мелких сосудах. В свою очередь, нарушение эндоневральной циркуляции способствует повышенному продуцированию свободных радикалов [2]. Применение a-липоевой кислоты в данном случае позволяет снизить продукцию AGE, улучшить эндоневральную циркуляцию, компенсировать недостаток глютатиона в нервных волокнах и тем самым улучшить проводимость импульсов по нервным волокнам [2].
В последнее время препараты a-липоевой кислоты стали применять в комплексной терапии СДС [6, 19].
Следует подчеркнуть, что при лечении нейропатической формы СДС важным является проведение разгрузки пораженной конечности (гипсовая лонгета, костыли, кресло-каталка). Отсутствие разгрузки делает лечение язвенного дефекта неэффективным [23, 28].
При лечении нейро-ишемических поражений, рекомендовалось воздействовать на сердечно-сосудистые факторы риска, прежде всего курение, нормализовать гликемические показатели, липидный спектр крови и массу тела [2, 3, 8].
Некоторые авторы считают, что сочетание дозированной физической активности с такими препаратами, как актовегин, достоверно увеличивает дистанцию ходьбы [12]. Эти препараты не обладают сосудорасширяющим и ангиопротекторным действием, но активируют обмен веществ в тканях; повышают синтез АТФ, потребление кислорода клетками, особенно в условиях гипоксии; ускоряют регенерацию поврежденных клеток и тканей; стимулируют ангиогенез [12]. По последним данным актовегин показал себя и как препарат, уменьшающий неврологический дефицит, а следовательно может быть рекомендован для патогенетической терапии диабетической полинейропатии.
При ЛБИ<0,5 или ТсрО2<30 мм Hg, консервативная терапия язвенных дефектов неэффективна. В этих случаях необходимо направлять пациента в отделение сосудистой хирургии.
Для улучшения кровоснабжения стопы клиницисты [8] используют шунтирование или ангиопластику, с лечением гнойно-некротического очага. Наиболее эффективным оперативным вмешательством является дистальная реконструкция (шунтирование артерий лодыжки или тыла ступни), которая необходима в 25% случаев у больных сахарным диабетом [8]. Распространенная ранее поясничная симпатэктомия признана устаревшей [8]. В западных клиниках широкое применение нашло эндоваскулярное стентирование. Использование этого метода позволяет избежать постоперационной реокклюзии сосудов, которое возникает в 50% случаев на протяжении одного года после проведенной операции.
В настоящее время при выборе медикаментозных средств для лечения трофических поражений нижних конечностей все большее внимание привлекает препарат системной энзимотерапии (СЭТ) «Вобензим», способный снижать активность воспалительных процессов путем уменьшения инфильтрации плазматическими белками интерстиция и увеличения элиминации белкового детрита и депозитов фибрина в зоне воспаления. Это, в свою очередь, обеспечивает восстановление микроциркуляции, утилизации продуктов воспаления, а также улучшению снабжения тканей кислородом [4, 11, 15]. Поступая в кровь, входящие в состав препарата ферменты связываются в основном с двумя ингибиторами: a2-макроглобулином (a2М) и a1-ингибитором протеиназ (a1ИП). Существенно, что последний полностью и необратимо инактивирует протеолитические ферменты, а a2М лишь ограничивает их способность действовать на большинство высокомолекулярных субстратов [15]. Комплексы a2Мпротеиназы поступют в общий кровоток ко всем органам и клеткам, имеющим на своей мембране рецептор к активированному a2М (легкие, печень), что может приводить к изменению их метаболизма. Например, увеличением антитоксической функции печени или усилением барьерной функции аэрогематического барьера, активацией неспецифической резистентности этих органов и как следствие – всего организма за счет интенсивности фагоцитоза, продукции супероксиданион радикала мононуклеарами, антимикробной защиты в целом.
Не связавшиеся с легочными и печоночными рецепторами комплексы a2М – протеиназа продолжают свой путь, поступая с общим кровотоком ко всем органам и прежде всего к клеткам, имеющим на своей поверхности рецептор к активированному a2М. Это макрофаги, клетки системы мононуклеарных фагоцитов (СМФ): макрофаги селезенки, костного мозга, гистиоциты соединительной ткани, кожи, клетки Купфера, остеокласты, клетки микроглии в нервной системе и т.д.
Активация СМФ многое может объяснить в механизмах СЭТ, причем этот метод может оказаться уникальным в своем роде, так как на сегодняшний день другие возможности физиологического воздействия на СМФ не найдены. Образование комплексов a2М-протеиназы стимулирует пролиферацию клеток соединительной ткани, что обеспечивает заживление с прекращением вторичной альтерации [15]. Поэтому ферменты, поступающие перорально, опосредуют свое действие через рецепторы к a2М, активизируя таким образом СМФ, которые, как известно, играют важнейшую регуляторную роль при воспалении. Энзимы воздействуют на каузальные факторы острого воспалительного процесса (простагландин, брадикинин, калликреин) и тем самым оказывают вторичное анальгезирующее воздействие [15]. Рутин, входящий в состав препарата, улучшает проницаемость сосудистой стенки, уменьшая отек [15]. Анализ клинической эффективности препарата системной энзимотерапии «Вобензим» показал, что использование последнего в схеме лечения нейропатических и нейроишемических трофических поражений нижних конечностей на протяжении 1,5 месяцев позволяет в 1,5 раза сократить сроки заживления язвенных дефектов [4]. Вышесказанное делает целесообразным использование препаратов СЭТ в комплексной терапии трофических язв нижних конечностей у больных СД.
Методы специализированной обработки трофических поражений
Обработка трофических язв заключается в механическом удалении участков гиперкератоза, некротизированных тканей, а также костных секвестров, а при необходимости в удалении гипергрануляций.
В плане местного лечения в первой фазе воспалительного процесса (альтерации) для обработки раны используют антисептические растворы (1% раствор диоксидина, эктерицид, хлоргексидин, диоксизоль и др.). Меняют повязки два раза в сутки [4, 6, 13].
В Великобритании широко используют окклюзионные повязки, которые поддерживают влажную среду в ране. Такие повязки очень удобны, так как их можно менять каждые 3–5 дней (в зависимости от интенсивности экссудации) [31, 33]. В отечественной хирургии для очистки дна раны от некротизированных тканей применяют ферменты (трипсин, ируксол). Английские специалисты считают, что ферментные препараты могут вызвать некрозы [28]. В клинике Института эндокринологии образование некротичеких очагов после применения указанных препаратов не было зарегистрировано.
В фазе пролиферации используют колла9. Ефимов А.С., Скробонская Н.А. Клиническая диабетология.— К.: Здоров’я, 1998.— 320 геновые материалы со стимулирующими репарацию добавками [28].
Процессы репарации у больных СД длительны. Зачастую язва с относительно здоровыми грануляциями не заживает в течение нескольких месяцев. Поэтому в последнее время с помощью генной инженерии были разработаны повязки Apligraf и Dermagraf, которые содержат протеины кожного матрикса и цитокины кожи человека. У 56% больных, принимавших участие в клинических испытаний таких материалов за 12 недель отмечалось 100%-ное заживление язвы. При этом использование традиционных методов было успешным лишь в 39% случаев [28].
Лечение больных СД с СДС — достаточно длительный процесс, требующий организации амбулаторной помощи в специализированных центрах до полного заживления дефекта. В связи с этим актуальным является вопрос о расширении сети специализированных кабинетов, оснащенных специальным оборудованием и подготовленным персоналом.
Список литературы:
1. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Микроангиопатия – одно из сосудистых ослонений сахарного диабета // Consilium medicum – 2000 T.2, №5.
2. Балаболкин М.И, Чернышева Т.Е., Трусов В.В., Гурьева И.В. Диабетическая нейропатия. Учебно-методическое пособие. – М., 2003.
3. Бегма А.Н., Бегма И.В., Демин Д.И., Поташев Д.А., Гурьева И.В. Земляной А.Б. Оптимизация лечения нейрон-ишемической формы синдрома диабетической стопы // Здравоохранение Урала. – 2003. №9.
4. Болгарська С.В. Диференційнодіагностичні особливості та підхід до лікування трофічних виразок нижніх кінцівок у хворих на цукровий діабет: Автореф. Дис…канд.мед.наук:14.01.14. / Інститут ендокринології та обміну речовин ім. В.П.Комісаренка АМН України. К., 2004. –17 с.
5. Гурьева И.В. Профилактика, лечение, медико-социальная реабилитация и организация междисциплинарной помощи больным с синдромом диабетической стопы: Дис…д-ра мед.наук. – М., 2001.
6. Гурьева И.В., Кузина И.В., Воронин А.В., Комелягина Е.Ю., Мамонтова Е.Ю. Синдром диабетической стопы. Методические рекомендации — М., 2000.— 40 с.
7. Дибиров М.Д, Черкезов Д.И.,
8. Дедов И.И., ШестаковаМ.В. Сахарный диабет.— М.: Медицина, 2003.— 143 с.с.
10. Зубкова С.Т. Особенности нарушений регионарной гемодинамики, кислородообеспечения тканей и пути их коррекции у больных с диабетическими ангиопатиями нижних конечностей: Дис…д-ра.мед.наук: 14.01.14. – К.,1989. – 335 с.
11. Корпан М.І., Чекман І.С., Фіалка В. Клініко-фармакологічні аспекти системної ензимотерапії // ІІ Націоналльний Конгрес ревматологів України: Матеріали наукових праць. –К.,1997. – 132 с.
12. Креминская В.М., Гурьева И.В. Возможность применения Актовегина при поздних осложнениях сахарного диабета //РМЖ. – 2006.
13. Левенець В.Н. «ДіоксизольДарниця»: досвіт застосування в хірургічній практиці // Хирургия.— 2001.— №4.— С. 5.
14. Международное Соглашение по диабетической стопе. – 2000.
15. Ноуза К., Масиновски З., Мухова Р. Системная єнзимотерапия: исследования и клиническая практика. – Мюнхен – Прага: Мед. Ово по изучению єнзимов, 1994. – С. 7-9.
16. Покровский А.В., Дан В.Н., Чупин А.В., Харазов А.Ф. Вазопростан (просётагландин Е1) в комплексном лечении больных с ишемической диабетической стопой // Ангиология и сосудистая хирургия.— 2000.— Т. 6.— №2.— С. 19–26.
17. Савран Е.В., Скибун В.Н. Антибактериальная терапия язвенно-некротических поражений стоп у больных сахарным диабетом. Применение Далацина Ц. // Український медичний часописю – 2001. №6 (26). – С. 58-61.
18. Светухин А.М., Баркаган З.С. Сулодексид. Механизмы действия и опыт клинического применения.— М.: Си Эс Си ЛТД, 2000.—124 с.
19. Скибун В.М. Патогенетичні аспекти терапії нейропатичної форми діабетичної стопи: Автореф. Дис…канд.мед.наук: 14.01.14. / Інститут ендокринології та обміну речовин ім. В.П.Комісаренка АМН України. К., 2003. – 17 с.
20. Токмакова А.Ю. Эффективность различных методов консервативной терапии у больных с синдромом диабетической стопы: Автореф. дис… канд. мед. наук. 14.00.14.— М.,1992.— 25 с.
21. Тронько Н.Д. Современные проблемы диабетологии // Журнал АМНУ.— 2000.— Т. 6, №3.— С. 460–471.
22. Armstrong D G, Nguyen H C (2000) Improvement in healing with aggressive edema reduction after debridement of foot infection in persons with diabetes. Arch Surg 135: 1405-1409.
23. Armstrong D G, Nguyen, H C, Lavery L A, van Schie C H M, Boulton A J M, Harkless L B (2001) Off-loading the diabetic foot wound. A randomized clinical trial. Diabetes Care, 24:1019-1022.
24. Boulton A.J.M. The diabetic foot: from art to science. The 18th Camillo Golgi lecture // Diabetologia. 2004.— V.47 (8)/ P.1343-1353
25. Edmonds M.E. Ulcer research classification consensus meeting // The diabetic Foot. –2002. – V.5. – P.12-14.
26. Gurieva I.V., Komelyagina E.U., Kuzina I.V. Effects of short course tretment with antioxidant a-lipoic acid in diabetic foot and diabetic foot risk group patients // Joint Meeting of Neurodiab and Diabetic Foot Study Group of the EASD.— 2000.— P. 23.
27. Young M., Breddy J.L., Veves A., Boulton A.J. The prediction of diabetic neuropathic foot ulceration using vibration perception thresholds // Diabetes Care.— 1994.— V. 17, No. 6.— P. 557–560.tes.
28. Clinical Guidelines for Type 2 Diabetes.









Комментировать